Таргетирование пептид-связывающих рецепторов на раковых клетках с помощью пептид-лекарственных конъюгатов

Содержание
- Аннотация
- 1. Введение: Необходимость таргетной доставки противоопухолевых препаратов
- 2. Рецепторы, связывающие пептиды, как мишени для доставки противоопухолевых препаратов
- 3. Таргетирование новых G-белок-связанных рецепторов
- 4. Малые молекулы для таргетинка рецепторов, связывающих пептины, на раковых клетках
- 5. Пептиды, нацеленные на рецепторы, как носители противоопухолевых препаратов
- 6. Вариации лекарственного груза в пептидно-лекарственных коньъюгатах, нацеленных на рецепторы
- 7. Заключение и перспективы
- 8. Конфликт интересов
- Источники литературы
В период смены сезонов иммунитет человека особенно уязвим. Обычно в это время активизируются вирусные инфекции и другие заболевания, а организм испытывает стресс от нехватки полезных веществ. Это приводит к снижению естественной способности защиты.
Заметить такое состояние легко. Чаще развивается простуда, проявляется сильная сонливость, утомляемость наступает гораздо быстрее, к тому же обостряются хронические заболевания. Как правило, сбой иммунной системы бывает вызван из-за нарушения баланса производства клеток, отвечающих за укрепление защитных сил.
Чтобы не допустить развития серьезных патологий, важно своевременно принимать меры для поднятия иммунитета. К тому же есть способы для профилактики иммунного сбоя в домашних условиях.
Признаки иммунного сбоя в организме
При нем поражаются оба типа иммунной защиты — врожденной и приобретенной. В самом организме в этот момент происходят следующие процессы:
- снижается количество тканевых макрофагов, нейтрофилов, моноцитов, базофилов, эозинофилов, лимфоцитов (Т, В-класса, естественных киллеров). Это приводит к тому, что иммунная система начинает хуже справляться со своими функциями;
- возникает нарушение в межклеточной коммуникации, которое приводит к дисбалансу различных иммунных реакций;
- происходит сбой производства сигнальных молекул, а также антител к различным угрозам для организма.
Иногда ситуация может развиваться в противоположную сторону и характеризоваться избыточной активностью иммунной системы и ошибками в её реакции. Такое состояние приводит к развитию аутоиммунных патологий.
Причины ослабления
Можно выделить несколько групп причин, которые сигнализируют нам о том, что иммунитет ослаблен. Одна из самых обширных групп – это образ жизни человека. К нему относят следующие факторы:
- Нарушения и расстройства пищевого поведения. Это может быть как переедание, так и просто рацион с высоким содержанием жиров и «быстрых» углеводов, с низким содержанием пищевых волокон, клетчатки, витаминов, аминокислот и других микроэлементов.
- Нехватка жидкости в организме. Это связано с неправильным питьевым режимом. Особенно, когда человек не пьет чистую воду, а заменяет её сладкими напитками, которые не приводят к насыщению организма влагой в достаточном количестве.
- Вредные привычки. Не секрет, что разрушительное влияние алкоголя и токсичный вред от курения – это основная причина многих патологий. Особенно, если это застолья с большим количеством алкоголя, жирной и вредной пищей, как бывает в праздники.
- Малоподвижный образ жизни. При отсутствии необходимой физической активности развиваются застойные процессы в тканях организма.
- Постоянный стресс. Он может быть связан с повышенной нервной нагрузкой на работе, а также с развитием нарушений, связанных с психикой.
- Плохая экология. Это может быть связано с жизнью в регионах с высоким радиационным загрязнением или с низким качеством воздуха.
Следующая группа причин обусловлена наличием различных заболеваний или последствий от неправильно подобранной терапии и длительным восстановлением организма от них. К таким патологиям относят:
- Заболевания кровеносной системы: анемия, лейкемия, лейкоз.
- Различные формы воспаления печени: гепатит, жировой гепатоз, цирроз.
- Системные заболевания: ревматоидный артрит, болезни соединительной ткани, псориаз.
- Болезни, связанные с нарушениями в обмене веществ: сахарный диабет, подагра.
- Патологии работы желудочно-кишечного тракта или дисбаланс его микрофлоры.
- Неконтролируемый прием лекарств, например, антибиотиков, иммуномодуляторов и гормонов.
Как укрепить иммунитет
Чтобы защитная система организма начала правильно работать, важно устранить причину, которая приводит к сбою. При стимуляции иммунитета нужно применять те способы укрепления, которые помогут его тренировать, а не заменят его функцию. И главное условие – это здоровый образ жизни. Только тогда иммунная система сможет правильно выполнять свою функцию.
Как повысить иммунитет взрослому: способы укрепления иммунитета
Закаливание
Оно очень полезно для организма, но нагрузки должны быть умеренными и наращиваться постепенно. Среди способов закаливания наиболее популярен – контрастный душ. Он позволяет тренировать сердечно-сосудистую систему, а также улучшает состояние кожи. Также закаливание стоит сочетать с частыми прогулками на свежем воздухе и проветриванием помещения. Начинать закаливающие процедуры можно только если вы полностью здоровы и после консультации с врачом.
Витамины и пробиотики
Множество людей страдает от гиповитаминоза – нехватки витаминов. Как известно, не все витамины синтезируются в организме человека, за исключением, например, витамина D и витаминов, синтезируемых бактериями кишечника.
Поэтому рекомендуется периодически проходить курсы поливитаминных препаратов. Особенно, в период болезней, стрессов, депрессий, беременности потребность в витаминах возрастает. Продолжительность курса определяется врачом и обычно составляет 1–3 месяца, курс желательно повторять 2–4 раза в год.
Кроме витаминов, для укрепления иммунной системы важны пробиотики – это лекарственные препараты или биологически активные добавки к пище, которые содержат в составе живые микроорганизмы, являющиеся представителями нормальной микрофлоры человека. Они помогут восстановить дисбаланс в ЖКТ, поэтому применяются для лечения и профилактики иммунодефицита, дисбактериоза, а также связанных с ними патологий.
Режим и физическая активность
Для нормальной работы всего организма и хорошего самочувствия человека важен правильный и стабильный режим жизни. Лучше всего вставать и ложиться спать примерно в одно и то же время. А также высыпаться, больше отдыхать и гулять на свежем воздухе.
Регулярная физическая активность благотворно влияет на иммунитет. Во время активной физической нагрузки повышается общий тонус организма, улучшается настроение, что способствует приливу энергии и жизненных сил. Это связано еще и с тем, что кровь обогащается кислородом, а в организме вырабатываются эндорфины («гормоны счастья»).
Отказ от вредных привычек
Любые вредные привычки: курение, алкоголь, прием наркотических средств, а также злоупотребление обезболивающими и антибиотиками – сильно ослабляют иммунную систему организма, а также ухудшают функционирование многих органов.
Продукты, поднимающие иммунитет
Для укрепления организма необходимо сбалансированное питание, богатое витаминами и микроэлементами. Для того чтобы вы получали все необходимые вещества и микроэлементы, питание должно быть максимально разнообразным.
Ежедневно в рационе должны присутствовать все основные группы продуктов: молочные, крахмалистые, овощи, фрукты, источники сложных углеводов, белка и жиров.
Сложные углеводы содержатся в крупах, макаронах, картофеле, хлебе с отрубями и в бездрожжевых хлебцах из цельного зерна. Они долго усваиваются, в отличие от простых углеводов, которые содержатся в сахаре, печенье, тортах и прочих сладостях.
Также человеку необходимы неперевариваемые углеводы – клетчатка или пищевые волокна. Они создают ощущение сытости и полезны для пищеварения. Такие углеводы содержатся в овсянке, а также в хлебе из муки грубого помола.
Кроме того, организму человека необходимы жиры, ведь именно они помогают усваивать витамины А и Е. При их недостатке – хуже выглядит кожа, страдает печень, перестают вырабатываться половые гормоны. Но важно учитывать, что жиры бывают насыщенными и ненасыщенными. Последние лучше усваиваются, соответственно, они более полезны. Их можно получать из жирных сортов рыбы, авокадо, миндаля, оливкового масла. А вот от употребления пищи, содержащей скрытые неполезные жиры, лучше отказаться (сосиски, колбасы).
Для восстановления и роста – организму необходим белок. Лучшие источники белка – это красная рыба, белое мясо птицы, молочные продукты, яйца, бобовые, орехи, грибы.
Как пептиды влияют на укрепление организма
Пептиды встраиваются в клетки и воздействуют на соответствующие функции, которые запускают процессы регенерации. Это не только способствует укреплению и омоложению организма, но и ускоряет процесс восстановления, например, после травм, хирургического вмешательства или длительного приема антибиотиков.
Усиление реакции иммунной системы при приеме пептидов
При восстановлении организма и борьбе с воспалительными процессами – пептиды помогают дополнить и улучшить функционирование иммунных клеток. Кроме того, такие вещества обладают репаративными и регенеративными свойствами.
Итог
Укрепление иммунитета позволяет не только улучшить качество жизни, но и влияет на её продолжительность, а также процессы старения организма. Основной способ повлиять на состояние иммунитета – это здоровый образ жизни, который включает в себя правильное питание, умеренную физическую активность, а также отказ от вредных привычек. Ускорить восстановление иммунитета можно с помощью пептидов и использования поливитаминных комплексов.
Аннотация
Целенаправленное воздействие на молекулы клеточной поверхности раковых клеток способствует разработке таргетных методов лечения рака, которые позволяют избирательно уничтожать злокачественные клетки, сохраняя при этом здоровые ткани. Таким образом, нежелательные побочные эффекты у пациентов с опухолями значительно снижаются. Рецепторы, связывающие пептиды, часто сверхэкспрессируются на раковых клетках и поэтому являются перспективными мишенями для селективной терапии опухолей. В данном обзоре суммированы рецепторы, связывающие пептиды, для доставки противоопухолевых препаратов, с акцентом на пептидные лиганды как средства доставки. В первой части представлены некоторые из наиболее изученных рецепторов, связывающих пептиды, а также рецептор грелина и Y1-рецептор, которые рассматриваются как новые мишени для терапии рака. Кроме того, описаны непептидные малые молекулы для таргетинга рецепторов на раковых клетках. Во второй части описаны пептидные конъюгаты для доставки терапевтических агентов в терапии рака. Указаны ключевые свойства пептидов, нацеленных на рецепторы, а также представлены последние достижения в области классических пептидно-лекарственных конъюгатов с токсичными агентами, меченых радионуклидами пептидов для радионуклидной терапии и боронированных пептидов для бор-нейтрон-захватной терапии.
Графическая абстракция
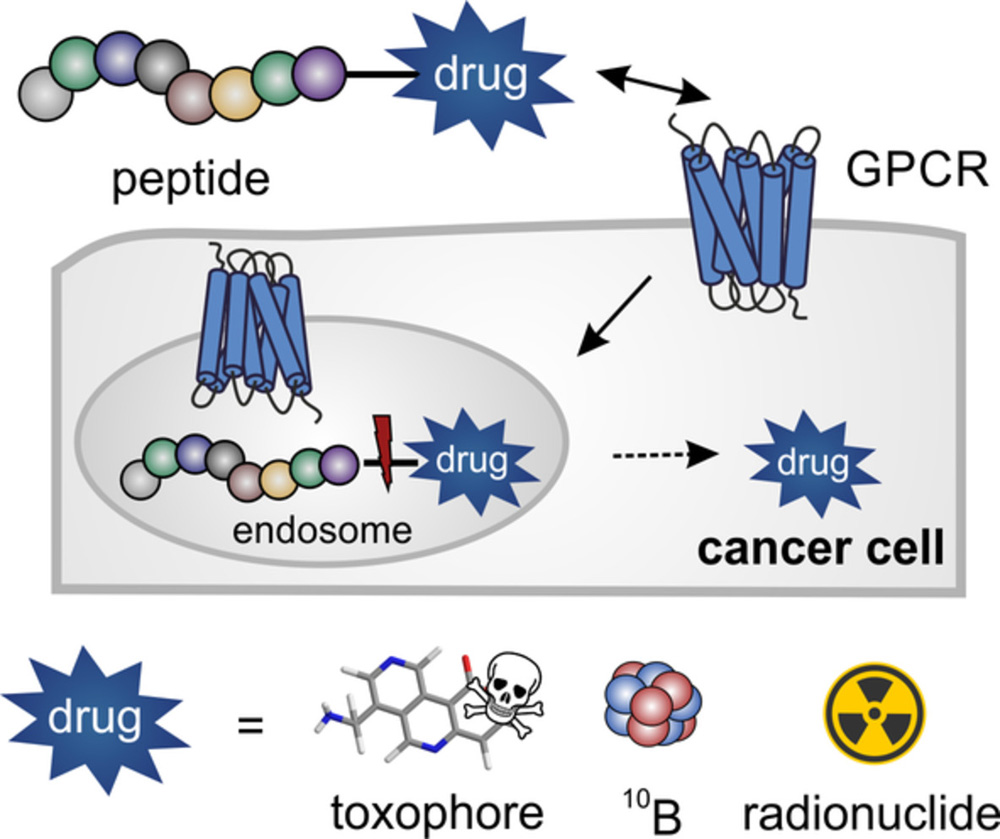
1. Введение: Необходимость таргетной доставки противоопухолевых препаратов
Рак является одной из ведущих причин смерти во всем мире, уступая только сердечно-сосудистым заболеваниям.[1, 2] В 2012 году количество новых случаев рака во всем мире оценивалось в 14,1 миллиона, а количество смертей от рака составило 8,2 миллиона.[3] У женщин наиболее часто встречающейся формой рака является рак молочной железы, тогда как у мужчин ведущим подтипом рака является рак легких.[3] Кроме того, Американское онкологическое общество заявило, что к 2030 году количество новых случаев рака может увеличиться до 21,7 миллиона, а количество смертей от рака может достичь 13 миллионов из-за роста численности населения мира.[2] Эта оценка ясно указывает на то, что усилия по разработке новых и более эффективных методов лечения рака должны быть усилены в будущем. Современное лечение рака осуществляется с помощью комбинации хирургических процедур, лучевой терапии и химиотерапии. Хотя последняя во многих случаях является мощным оружием в борьбе с раком, более детальное рассмотрение этого метода лечения показывает, что требуется дальнейшая оптимизация. Химиотерапия до сих пор в основном проводится путем системного введения мощных цитотоксических препаратов, но эти соединения не обладают избирательностью к опухоли и, следовательно, также уничтожают здоровые клетки в организме. Возникающая в результате периферическая токсичность является причиной серьезных побочных эффектов при химиотерапии.[4] Описанная неспецифичность характерна не только для химиотерапевтических агентов, но и для любых терапевтически активных молекул, которые вводятся системно без наличия встроенного сенсора раковых клеток. Однако свойства, позволяющие распознавать раковые клетки, необходимы для достижения конечной цели таргетной терапии опухолей с использованием лекарственных молекул.[5, 6] В самом общем виде идея заключается в использовании любых биохимических характеристик, которые отличают раковые клетки от здоровых, для достижения селективного терапевтического эффекта только в злокачественных клетках. Такие характеристики могут включать дисрегуляцию трансляционных регуляторов,[7] изменения в механизмах эпигенетической регуляции,[8] избыточное производство ферментов,[9] или изменения в клеточной микроокружении, такие как более низкий уровень pH.[10] Кроме того, раковые клетки могут быть адресованы с помощью активно таргетированной доставки противоопухолевых препаратов благодаря сверхэкспрессии различных рецепторов на клеточной поверхности, которые связываются с лигандами различной природы.[11]
2. Рецепторы, связывающие пептиды, как мишени для доставки противоопухолевых препаратов
Клеточные рецепторы, активируемые пептидными молекулами в качестве лигандов, представляют большой интерес для таргетной терапии опухолей.[11, 12] Эти рецепторы должны удовлетворять двум основным критериям: во-первых, рецептор должен быть уникально или значительно сверхэкспрессирован на раковых клетках по сравнению с нормальными клетками. Обычно желательно соотношение экспрессии опухоль/нормальные клетки 3:1 или выше. Во-вторых, общий уровень экспрессии целевого рецептора на раковых клетках должен быть достаточно высоким, чтобы обеспечить доставку достаточного количества препарата для достижения желаемого терапевтического эффекта. Многие рецепторы, связывающие пептиды, обладают этими характеристиками, и, соответственно, их активирующие пептидные лиганды (агонисты) являются перспективными селективными носителями для использования в лекарственных конъюгатах.[13, 14] Кроме того, таргетинг рецепторов, связывающих пептиды, может быть достигнут с помощью химически разработанных малых молекул или антител.[15, 16] Направленная доставка препарата становится возможной благодаря созданию модульной системы конъюгатов, состоящей из лекарственного соединения, ковалентно связанного с молекулой, связывающей рецептор (Рисунок 1). В идеале последняя также должна обеспечивать проникновение в раковые клетки для селективной внутриклеточной доставки препарата. Во многих случаях между препаратом и таргетингующим модулем дополнительно используется «умный» линкер, чтобы облегчить контролируемое высвобождение препарата внутри опухолевых клеток.[17]
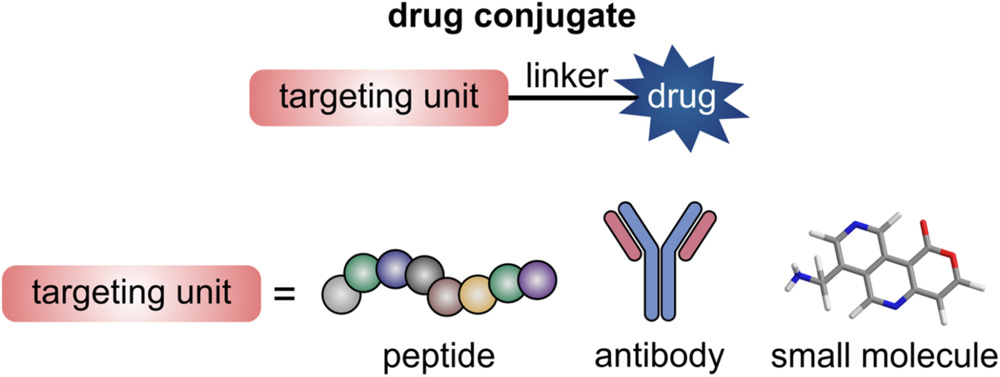
Рисунок 1
Схематическое строение рецептор-направленного лекарственного конъюгата.
Помимо прямой конъюгации препарата с носителем, в качестве платформ доставки используются липосомы и наночастицы.[18-20] В этом подходе частицы загружаются лекарственным соединением, а их поверхность модифицируется лигандами, нацеленными на рецепторы, чтобы обеспечить доставку в опухолевые клетки. Модификация поверхности полимерных наномедицинских препаратов таргетингующими лигандами, например, пептидами, может преодолеть присущие недостатки ненацеленных частиц, включая низкую селективность к клеткам и неэффективный клеточный захват, в то время как сами полимерные наномедицинские препараты обеспечивают повышенную стабильность и возможность доставки большого количества молекул препарата на одну частицу в клетки. Пептид-функционализированные наномедицинские препараты были значительно оптимизированы за последние годы, что обсуждается в различных обзорах.[20-22] Однако в данном обзоре основное внимание уделяется конъюгатам, в которых препарат непосредственно связан с таргетингующим модулем, с акцентом на пептиды как носители. Далее представлены некоторые из наиболее изученных рецепторов, связывающих пептиды, которые используются для таргетной терапии опухолей с помощью лекарственных конъюгатов.
2.1 Интегрины
Интегрины представляют собой семейство трансмембранных (TM) рецепторов, которые существуют в виде гетеродимеров из вариабельных и нековалентно связанных α- и β-субъединиц.[23] Они связывают внеклеточный матрикс (ECM) с цитоскелетом, опосредуя такие процессы, как адгезия клеток, миграция и пролиферация.[24] Поскольку все эти процессы имеют большое значение для канцерогенеза, интегриновые рецепторы обнаруживаются сверхэкспрессированными в различных подтипах рака.[25] Среди семейства интегринов наиболее привлекательной мишенью является αvβ3 из-за его важности в ангиогенезе опухолей и метастазировании.[26] Таргетинг αvβ3 может быть осуществлен с использованием трипептидного мотива аргинин-глицин-аспарагиновая кислота (RGD), который обнаружен в различных белках ECM.[27, 28] Циклический вариант c(RGDfK) используется в качестве предпочтительной системы-носителя для конъюгации препаратов благодаря его улучшенному сродству к интегриновым рецепторам.[29-31] Однако механизм интернализации RGD-пептидов после связывания с интегринами до конца не изучен, и мультимерные пептиды демонстрируют более высокий клеточный захват.[32] Кроме того, циклический 9-мерный пептид iRGD (CRGDKGPDC) используется как «умное» средство доставки для обеспечения эндоцитозного захвата препаратов раковыми клетками.[33]
2.2 Рецептор эпидермального фактора роста
Рецептор эпидермального фактора роста (EGFR) является частью семейства рецепторных тирозинкиназ ErbB, состоящего из четырех членов: EGFR/HER1 (ErbB-1), HER2/neu (ErbB-2), HER3 (ErbB-3) и HER4 (ErbB-4).[34] Сверхэкспрессия EGFR в очень высоких уровнях наблюдалась при различных типах рака и связана с сильно усиленной пролиферацией раковых клеток.[35] Ингибирование EGFR для достижения антипролиферативного эффекта уже применяется в клинической практике с использованием моноклональных антител или малых молекул-ингибиторов.[36] Однако благодаря своему механизму интернализации EGFR также рассматривается как система захвата для доставки препаратов. Несколько коротких пептидов с высоким сродством и селективностью к EGFR были обнаружены с помощью библиотек фагового дисплея и могут использоваться в качестве таргетных носителей препаратов.[37, 38]
2.3 Соматостатиновые рецепторы
Класс соматостатиновых рецепторов (SSTRs) включает пять членов (SSTR1-5), которые широко экспрессируются в различных тканях организма, включая нервные клетки, гипофиз, почки, легкие и иммунные клетки.[39] Их естественным лигандом является нейропептид соматостатин (SST), который существует в двух активных изоформах: SST-14 и SST-28. В сочетании со своими рецепторами обе изоформы действуют как ингибирующие гормоны.[39] Важной физиологической функцией оси SSTR/SST является, например, ингибирование высвобождения гормонов роста.[39, 40] Сверхэкспрессия SSTRs, особенно SSTR2, обнаружена при различных нейроэндокринных опухолях, а также при других опухолях, таких как рак молочной железы, яичников и легких.[41] Таргетинг SSTR2 для доставки препаратов осуществляется с использованием стабилизированных циклических аналогов соматостатина, таких как октреотат, октреотид и ланреотид.[42] Эти пептиды также непосредственно используются в терапии для применения ингибирующих эффектов, опосредованных SSTRs, при лечении опухолей, продуцирующих гормоны роста.[43]
2.4 Рецептор гонадотропин-рилизинг гормона
Рецептор гонадотропин-рилизинг гормона (GnRH-R) в основном экспрессируется на гонадотропных клетках гипофиза, но также обнаруживается в лимфоцитах, молочной железе, яичниках и простате.[44] Активация GnRH-R в гипофизе лигандами GnRH-I и GnRH-III приводит к секреции двух гонадотропинов: фолликулостимулирующего гормона и лютеинизирующего гормона.[45] GnRH-R стал высокоперспективной мишенью для таргетной терапии, поскольку несколько типов человеческих опухолей, включая рак яичников, простаты, молочной железы и легких, сверхэкспрессируют или даже уникально экспрессируют этот рецептор по сравнению с окружающими нормальными клетками.[46] Таргетинг GnRH-R с использованием активирующих пептидов или малых молекул-агонистов уже применяется в терапии рака.[47] Для создания лекарственных конъюгатов чаще всего используются модифицированные аналоги GnRH [d-Lys6]-GnRH-I и [Lys4]-GnRH-III.[48, 49]
2.5 Бомбезиновые рецепторы
Семейство бомбезиновых (Bn) рецепторов включает три члена: BB1, BB2 и BB3. Все Bn-рецепторы широко экспрессируются в центральной нервной системе (ЦНС), а также на периферии, например, в желудочно-кишечном тракте.[50] Они опосредуют множество физиологических функций, включая аутокринное действие на рост клеток и мощные эффекты в ЦНС. Естественным пептидным лигандом для BB1 является нейромедин B, а для BB2 — гастрин-рилизинг пептид, тогда как BB3 считается орфанным рецептором.[50] Однако 14-мерный пептидный гомолог Bn, первоначально выделенный из кожи европейской жерлянки,[51] способен связываться со всеми Bn-рецепторами. Повышенная экспрессия Bn-рецепторов обнаружена при различных подтипах рака, и особенно BB2 сильно сверхэкспрессирован при опухолях, таких как рак молочной железы, простаты, мелкоклеточный рак легких и рак поджелудочной железы.[52, 53] Таргетинг Bn-рецепторов для доставки препаратов может быть осуществлен с использованием ряда аналогов Bn, включая, например, пептид [d-Tyr6,β-Ala11,Phe13,Nle14]-Bn(6-14) как высокоаффинный агонист для всех Bn-рецепторов.[54]
2.6 Другие пептидные рецепторы
Помимо этих пяти рецепторов, ряд других пептидных рецепторов исследуется как потенциальные мишени для доставки противоопухолевых препаратов. Это включает, например, рецепторы вазоактивного интестинального пептида (VIP) 1 и 2, которые сверхэкспрессируются при различных раках, таких как рак толстой кишки, молочной железы и эндокринные опухоли.[12] Естественный лиганд VIP и его аналоги исследуются для создания лекарственных конъюгатов.[55, 56] Рецептор нейротензина 1 (NTSR1) был обнаружен сверхэкспрессированным при ряде различных подтипов рака, включая рак молочной железы, толстой кишки, поджелудочной железы, легких и простаты.[57] Для доставки препаратов короткий гексапептид нейротензин(8-13) может использоваться в качестве носителя с высокой селективностью и сродством к NTSR1.[58, 59] Также представляет интерес холецистокининовый рецептор 2 (CCK2R), который сверхэкспрессируется при различных раках щитовидной железы, легких, поджелудочной железы, печени и желудочно-кишечного тракта.[60, 61] Таргетинг этого рецептора для доставки препаратов может быть осуществлен с использованием аналогов его естественных пептидных лигандов холецистокинина и гастрина.[62, 63] Рецептор меланокортина 1 (MC1R) был обнаружен сверхэкспрессированным при злокачественной меланоме.[64] Поскольку успех традиционной химиотерапии для лечения метастатической меланомы довольно ограничен,[65] таргетная терапия, направленная на MC1R, является перспективным подходом. Для создания лекарственных конъюгатов для этой системы укороченные пептидные аналоги естественного лиганда MC1R α-MSH, например, агонист NAPamide, обладают потенциалом в качестве средств доставки.[66]
3. Таргетирование новых G-белок-связанных рецепторов
Большинство рецепторов, связывающих пептиды, которые используются для доставки препаратов в терапии рака, относятся к классу G-белок-связанных рецепторов (GPCR). За исключением интегринов и EGFR, это справедливо для всех рецепторов, представленных до сих пор. GPCR состоят из семи трансмембранных (TM) спиралей, соединенных тремя внутриклеточными и тремя внеклеточными петлями, внеклеточным N-концом и внутриклеточным C-концом.[67] После связывания лиганда эти рецепторы претерпевают лиганд-специфические конформационные изменения,[68] что позволяет им активировать гетеротримерные G-белки на внутриклеточной стороне плазматической мембраны, что инициирует сигнальный каскад.[69] После активации рецептора большинство GPCR десенсибилизируются путем внутриклеточного фосфорилирования, рекрутирования адапторного белка аррестина и, наконец, интернализации через клатрин-опосредованный эндоцитоз,[70] что делает их чрезвычайно интересными для внутриклеточной доставки препаратов (Рисунок 2). GPCR образуют крупнейшее суперсемейство клеточных поверхностных рецепторов с более чем 800 членами у человека и выполняют множество разнообразных физиологических функций. Они являются наиболее успешным классом фармакологических мишеней и также вовлечены в канцерогенез.[71] В данном обзоре основное внимание уделяется двум GPCR, которые недавно были рассмотрены как мишени для доставки препаратов в терапии рака. Оба рецептора и их лиганды представлены более подробно.
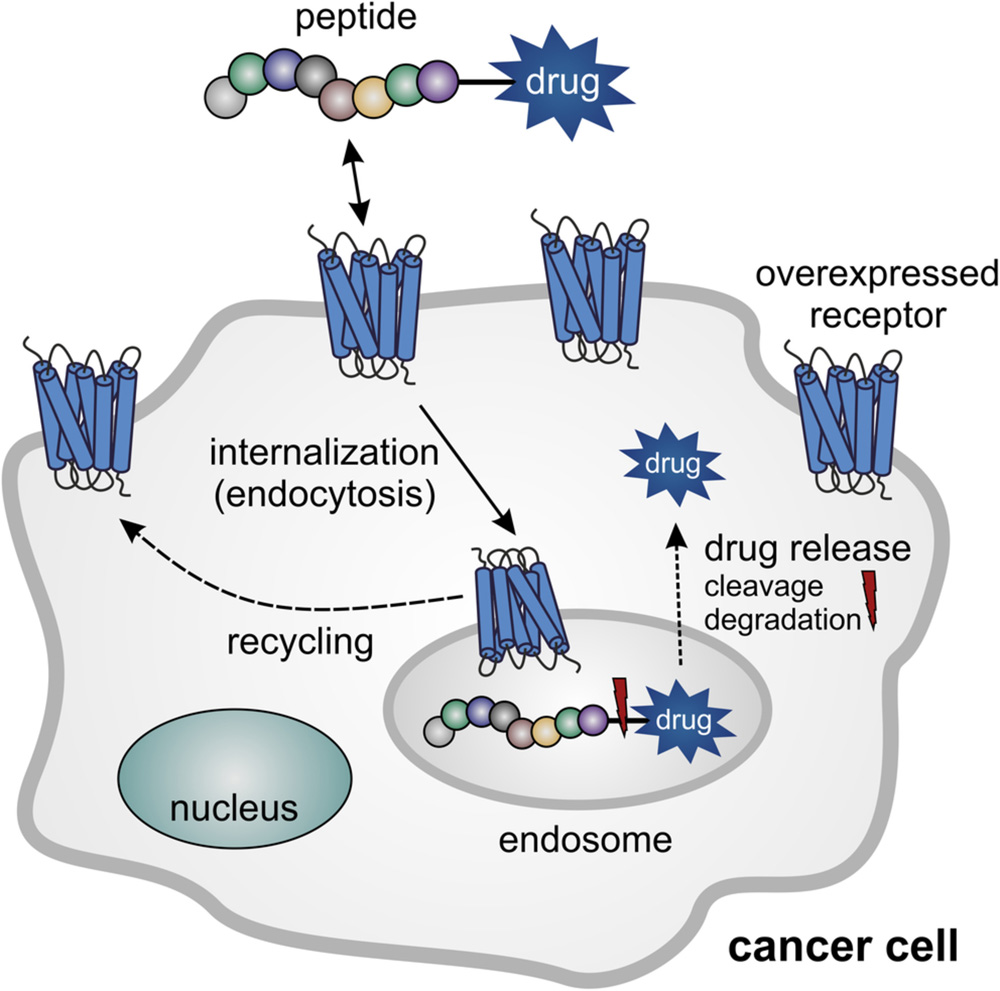
Рисунок 2
Схематическое изображение нацеливания на экспрессируемый опухолью G-белок-сопряженный рецептор для доставки противоопухолевого препарата с помощью пептид-лекарственного конъюгата. Препарат высвобождается внутриклеточно за счет использования расщепляемого линкера или в результате эндо-лизосомальной деградации пептид-лекарственного конъюгата.
3.1 Рецептор грелина
Рецептор грелина (GhrR), также известный как рецептор секретагога гормона роста 1a (GHSR1a), относится к классу A GPCR и был впервые идентифицирован Смитом и соавт. в 1996 году.[72] Он широко экспрессируется в головном мозге, особенно в гипоталамусе, а также в гиппокампе и гипофизе. Кроме того, GhrR был обнаружен в различных периферических тканях, включая печень, сердце, поджелудочную железу, щитовидную железу, яичники, яички и другие.[73, 74] Сплайс-вариант GhrR, названный GHSR1b, также широко экспрессируется в организме человека, однако этот подтип описывается как нефункциональный сам по себе.[75] Естественным лигандом GhrR является пептидный гормон грелин, который был открыт Кодзимой и соавт. в 1999 году и в основном вырабатывается в желудке.[76] Грелин представляет собой 28-аминокислотный пептид, ацилированный n-октановой кислотой по остатку Ser3 в своей пептидной последовательности, что необходимо для активности на рецепторе.[77] Ось грелин/GhrR играет роль в множестве физиологических функций, таких как потребление пищи,[78, 79] регуляция энергетического гомеостаза,[80] высвобождение различных гормонов (например, гормона роста, пролактина, адренокортикотропного гормона)[81] и поведение, связанное с поиском вознаграждения.[82] Важной особенностью GhrR является его конститутивная активность, не зависящая от лиганда.[83] Предполагается, что эта базальная сигнальная активность обеспечивает постоянное влияние на ось гормона роста, способствуя развитию нормального роста у человека.[84]
Связывание лиганда с GhrR происходит глубоко в полости, образованной TM-спиралями рецептора. После активации рецептора в результате связывания лиганда классическим сигнальным путем GhrR является путь, опосредованный Gαq/11.[85] Активация Gαq/11-белка рецептором стимулирует фосфолипазу C, которая расщепляет мембранный липид фосфоинозитол-4,5-бисфосфат на инозитолтрифосфат (IP3) и диацилглицерин. IP3 затем запускает высвобождение ионов кальция из эндоплазматического ретикулума в цитозоль.[86] Помимо пути, связанного с Gαq/11, после активации GhrR описано инициирование множества других внутриклеточных сигнальных каскадов.[85] Как и для большинства GPCR, десенсибилизация GhrR происходит путем интернализации в клатрин-покрытых везикулах, и пик этого процесса наблюдается примерно через 20 минут после стимуляции лигандом. Внутри клетки GhrR сортируется в эндосомы и активно рециклируется обратно на плазматическую мембрану.[87] Благодаря своей конститутивной активности интернализация рецептора грелина также происходит независимо от лиганда и аррестина.[88]
GhrR широко изучался как терапевтическая мишень, в основном из-за его влияния на ось гормона роста и стимуляцию аппетита. Однако GhrR также может рассматриваться для терапии рака, поскольку он был обнаружен в большом количестве различных подтипов рака. Экспрессия GhrR была описана при аденомах гипофиза, раке щитовидной железы, молочной железы, легких, яичек, яичников, простаты, желудка и колоректальном раке, а также при астроцитомах.[89, 90] Недавно пан-раковый анализ выявил сильную активацию GhrR при раке поджелудочной железы.[91] На данный момент точная роль оси грелин/GhrR в стимулировании или ингибировании прогрессирования рака остается неясной, и результаты исследований частично противоречивы.[91]
Таргетинг GhrR для терапии в целом исследуется с использованием различных лигандных молекул. Благодаря их способности стимулировать потребление пищи и высвобождение гормона роста, агонисты GhrR, например, рассматриваются для лечения кахексии при раке или слабости у пожилых людей. Антагонисты изучаются для лечения ожирения из-за их анорексигенного эффекта.[92] Кроме того, инверсные агонисты исследуются для лечения ожирения благодаря их способности подавлять базальную активность GhrR.[93] Многие из разработанных лигандов являются пептидными, однако также было синтезировано большое количество пептидомиметиков и малых молекул, которые связываются и действуют на GhrR.[94] Для использования в таргетной доставке противоопухолевых препаратов короткие пептидные агонисты, которые позволяют легко синтезировать и модифицировать их с лекарственным грузом, являются перспективным выбором. Они интернализируются вместе с GhrR после активации и, таким образом, обеспечивают внутриклеточный захват препарата. Кроме того, описанный рециклинг GhrR позволяет осуществлять многократную доставку препарата в клетки, экспрессирующие рецептор. Малые пептидные агонисты для GhrR были описаны еще до открытия эндогенного лиганда грелина.[95] Обычно они классифицируются в зависимости от пептида, из которого они происходят, например, укороченные и модифицированные версии самого грелина.[96]
Другой известный класс пептидных агонистов GhrR — это секретагоги гормона роста, структурно связанные с Met-энкефалином. К ним относятся, например, пептид, высвобождающий гормон роста 2 (GHRP-2), GHRP-6 (Рисунок 3A), гексарелин, алексаморелин и ипаморелин.[96] Кроме того, были описаны пептидные агонисты, полученные из аналога вещества P [d-Arg1,d-Phe5,d-Trp7,9,Leu11]-субстанция P, который сам по себе является инверсным агонистом на GhrR.[97] C-терминальный пентапептид wFwLL-NH2 был идентифицирован как минимальная последовательность, способная связываться с GhrR.[98] N-терминальное удлинение пентапептида аланином привело к созданию агониста,[99] а замена лейцин-лейцинового мотива на изонипекотиновую кислоту привела к созданию аналога, демонстрирующего сигнальную предвзятость на GhrR.[100] Кроме того, гексапептид KwF-(d-2-Nal)-LL-NH2 был описан как агонист с эффективностью, сопоставимой с эндогенным лигандом грелином (Рисунок 3B).[101] Несмотря на сверхэкспрессию GhrR при различных типах опухолей, в литературе до сих пор нет сообщений о конъюгатах, нацеленных на GhrR, для доставки противоопухолевых препаратов.
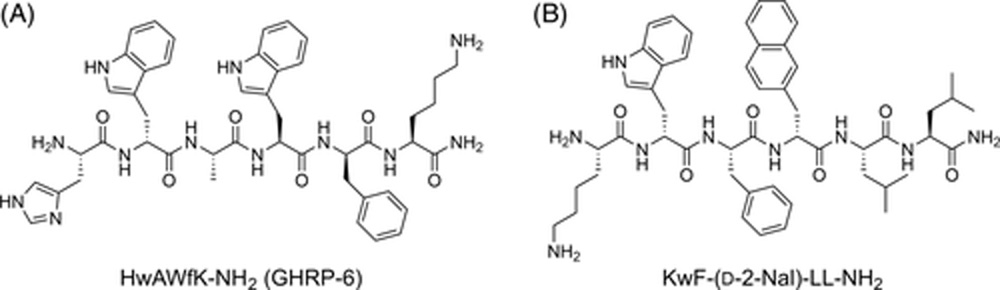
Рисунок 3
Химические структуры:
- Мет-энкефалин-производного GHRP-6 (пептида, высвобождающего гормон роста).
- Вещества P-производного KwF-(d-2-Nal)-LL-NH2 в качестве двух примеров коротких синтетических агонистов рецептора грелина.
GHRP – пептид, высвобождающий гормон роста.
3.2 Человеческий Y1-рецептор и его лиганд нейропептид Y
Человеческий Y1-рецептор (hY1R) относится к классу A GPCR из семейства Y-рецепторов у человека и преимущественно экспрессируется в ЦНС, например, в гипоталамусе, но также обнаруживается в периферических тканях, включая сердце, легкие и гладкие мышцы.[102, 103] Он участвует в различных физиологических функциях, таких как потребление пищи,[104] модуляция тревожности,[105] и вазоконстрикция.[106] Помимо hY1R, у человека экспрессируются три других Y-рецептора: Y2-рецептор (hY2R), Y4-рецептор (hY4R) и Y5-рецептор (hY5R).[107] Эти рецепторы связываются и активируются семейством пептидных гормонов нейропептида Y, которое включает нейропептид Y (NPY), пептид YY (PYY) и человеческий панкреатический полипептид (hPP).[108] Семейство Y-рецепторов/NPY-гормонов образует мультилигандную/мультирецепторную систему. В то время как NPY и PYY демонстрируют высокое сродство к hY1R, hY2R и hY5R, hPP имеет наибольшее сродство к hY4R.[109] Активация всех Y-рецепторов их естественными лигандами приводит к инициированию сигнального каскада, связанного с Gαi-белком,[110] что приводит к ингибированию аденилатциклазы и, следовательно, снижению внутриклеточного уровня вторичного мессенджера цАМФ. Десенсибилизация Y-рецепторов происходит через клатрин-опосредованный эндоцитоз в комплексе с связанным лигандом, как описано ранее. hY1R, hY2R и hY4R интернализируются быстро, в течение нескольких минут, тогда как процесс интернализации для hY5R значительно медленнее. Рециклинг hY1R и hY2R обратно на плазматическую мембрану наблюдается через быстрые и медленные эндосомальные пути.[111, 112]
NPY был обнаружен как наиболее распространенный пептидный гормон в ЦНС млекопитающих.[113] Для достижения селективного терапевтического таргетинга семейства Y-рецепторов с помощью NPY возникло желание создать пептидные варианты, которые предпочтительно связываются и активируют только один из Y-рецепторов. Эндогенный NPY представляет собой 36-аминокислотный пептид и состоит из гибкого N-конца, C-терминальной амфипатической α-спирали и амидированного C-конца (Рисунок 4A).[114] Индукция структурных изменений в NPY путем модификации его основной последовательности позволила получить желаемые пептидные варианты, предпочитающие определенные Y-рецепторы. Замена большой средней части на аминогексановую кислоту привела к созданию производного [Ahx(5-24)]-NPY, селективного лиганда для Y2-рецептора.[115] Укороченный, C-терминально производный аналог NPY [Pro30,Nle31,Bpa32,Leu34]-NPY(28-36) был идентифицирован как селективный агонист Y1-рецептора.[116] Кроме того, две аминокислотные замены в N-терминальной и самой C-терминальной части NPY привели к созданию полной версии [F7,P34]-NPY (Рисунок 4B), предпочитающей hY1R, с наномолярной активностью на hY1R и значительно сниженным сродством к hY2R.[117] Недавно была определена кристаллическая структура hY1R в комплексе с двумя различными антагонистами.[118] Использование этих структурных данных в сочетании с молекулярным докингом, ЯМР, сшиванием и функциональными исследованиями позволило более детально охарактеризовать сайт связывания NPY на hY1R, чем это было известно ранее. Этот научный прорыв может позволить дальнейшую оптимизацию селективных лигандов для рецепторов в будущем.

Рисунок 4
- Трехмерная структура человеческого нейропептида Y (NPY) в растворе, определенная методом ядерного магнитного резонанса (ЯМР) (PDB: 1RON).
- Аминокислотные последовательности pNPY и [F7,P34]-NPY, предпочитающего hY1R. Замененные аминокислоты выделены жирным шрифтом.
В прошлом таргетинг hY1R для терапии часто исследовался с использованием антагонистов благодаря их потенциальному анорексигенному эффекту.[119] Однако присутствие hY1R в определенных опухолевых тканях делает его также крайне интересной мишенью для доставки противоопухолевых препаратов. Экспрессия hY1R вместе с hY2R была описана при опухолях полового тяжа и стромы яичников, нефробластомах, гастроинтестинальных стромальных опухолях и опухолях яичек.[120] Исключительная экспрессия hY1R наблюдалась при опухолях коры надпочечников и почечно-клеточной карциноме, однако в этих случаях hY1R также экспрессируется в аналогичной степени в неопухолевой ткани происхождения.[120] Высокая экспрессия hY1R была также обнаружена в опухолях саркомы Юинга, но присутствие в окружающих нормальных клетках не исследовалось.[121] Помимо упомянутых типов опухолей, выдающийся профиль экспрессии hY1R был идентифицирован при раке молочной железы, что делает этот подтип рака наиболее перспективным для терапевтического подхода, нацеленного на hY1R. Reubi и соавт. сообщили в 2001 году, что hY1R экспрессировался в очень высокой плотности в 85% исследованных первичных опухолей молочной железы человека и в 100% метастазов, происходящих из рака молочной железы.[122] В отличие от этого, в окружающей неопухолевой ткани молочной железы преимущественно наблюдалась экспрессия hY2R. Таким образом, изменение паттерна экспрессии Y-рецепторов во время неопластической трансформации ткани молочной железы позволяет осуществлять специфическую доставку препаратов в опухоли молочной железы при использовании лиганда, предпочитающего hY1R, в качестве агента доставки. Полный агонист, такой как [F7,P34]-NPY, рекомендуется для получения полного преимущества от быстрой интернализации и кинетики рециклинга hY1R. Успешный таргетинг hY1R на опухолевых клетках молочной железы in vivo уже был продемонстрирован. Был приготовлен фтор-18 (18F)-меченый, фторгликозилированный аналог [F7,P34]-NPY, который позволил визуализировать опухоль MCF-7, экспрессирующую hY1R, у мышей с помощью позитронно-эмиссионной томографии (ПЭТ) мелких животных, что указывало на захват пептидного конъюгата опухолевыми клетками.[123] Кроме того, [F7,P34]-NPY был N-терминально мечен технецием-99m (99mTc) и введен четырем пациентам с опухолями молочной железы. Четкая визуализация опухолей или метастатических участков у всех пациентов с помощью сцинтимаммографии всего тела показала, что пептидный конъюгат может быть также специфически доставлен в клетки рака молочной железы у человека.[124] В дополнение к использованию [F7,P34]-NPY, Zhang и соавт. сообщили о коротком аналоге NPY [Lys(Pip-68Ga-DOTA)4,Bip5]BVD15 (BVD15: [Pro30,Tyr32,Leu34]-NPY(28-36)), который способен связывать hY1R in vivo, что было продемонстрировано с помощью ПЭТ-изображений с высоким контрастом ксенотрансплантатов опухолей HEK293T::hY1R у мышей.[125] Помимо валидации связывания hY1R in vivo с помощью визуализирующих агентов, [F7,P34]-NPY также использовался в первых исследованиях для создания соединений для доставки препаратов для таргетной терапии опухолей. За исключением этого, лишь несколько других публикаций описывают дизайн противоопухолевых препаратов, нацеленных на hY1R. Однако все эти подходы используют платформы на основе наночастиц, декорированные пептидами, связывающими hY1R, в качестве таргетингующих единиц.[126-129]
4. Малые молекулы для таргетинка рецепторов, связывающих пептины, на раковых клетках
Непептидные малые молекулы для таргетинга рецепторов, связывающих пептиды, уже утверждены как непосредственно действующие терапевтические соединения в лечении рака. Наиболее интуитивная идея заключается в использовании антагонистов, которые блокируют промалигнантные эффекты сигнальных путей пептидных рецепторов. Ингибирование EGFR с помощью малых молекул-антагонистов приводит к антипролиферативному эффекту на те опухолевые клетки, которые имеют активирующую мутацию в гене EGFR, и используется для лечения немелкоклеточного рака легких.[36] Несколько ингибиторов EGFR уже одобрены для этой цели.[130] Кроме того, блокирование сигналинга GnRH-R на опухолевых клетках с помощью мощных антагонистов ингибирует высвобождение гонадотропинов и, следовательно, также приводит к антипролиферативному эффекту. В настоящее время Elagolix является единственным непептидным антагонистом GnRH-R, представленным на рынке, но несколько других находятся в разработке.[131] Помимо этого, было разработано большое количество конъюгатов малых молекул с препаратами (SMDCs) для таргетной терапии опухолей. Практически все они нацелены на ферменты, ассоциированные с плазматической мембраной, транспортные белки или клеточные поверхностные рецепторы, которые не являются пептидными рецепторами. Разнообразие различных SMDCs было подробно описано в нескольких обзорных статьях.[15, 132] Одним из наиболее изученных классов SMDCs являются соединения, нацеленные на рецептор фолиевой кислоты. Например, винтафолид состоит из фолиевой кислоты в качестве таргетингующего модуля, соединенного с химиотерапевтическим агентом дезацетилвинбластином через пептидный спейсер и линкер, высвобождающий препарат внутриклеточно.[133, 134] Он исследовался для лечения рака яичников, но в конечном итоге не прошел фазу 3 клинических испытаний.[135] До сих пор был описан только один SMDC, нацеленный на пептидный рецептор. Wayua и соавт. описали создание высокоаффинного лиганда малой молекулы для CCK2R, конъюгированного с двумя различными ингибиторами микротрубочек в качестве химиотерапевтических агентов через гидрофильный пептидный линкер. Одно из соединений показало высокую эффективность в подавлении роста опухоли в ксенотрансплантатах HEK293, экспрессирующих CCK2R, у мышей.[136]
Помимо исследований в качестве SMDCs, непептидные лиганды также разрабатываются как (преимущественно диагностические) инструменты для визуализации сверхэкспрессированных рецепторов, связывающих пептиды, на опухолевых клетках. Например, ингибиторы EGFR были мечены углеродом-11 (11C) или 18F и исследованы в качестве ПЭТ-агентов для обнаружения опухолей, экспрессирующих EGFR, и опухолей с мутированным геном EGFR.[137] Кроме того, был описан антагонист CCK2R, производное бензодиазепина, соединенное с красителем ближнего инфракрасного диапазона (NIR) через гидрофильный пептидный спейсер, как потенциальный агент для флуоресцентно-направленной хирургии рака.[138] Соединение (S)-6-(4-бром-2-фторфенокси)-3-((1-изопропилпиперидин-3-ил)метил)-2-метилпиридо[3,2-d]пиримидин-4(3H)-он, его энантиомер и вариант без метильной группы в пиримидиновом кольце были идентифицированы как частичные агонисты с высоким сродством и селективностью к GhrR и поэтому рассматриваются как подходящие родительские молекулы для радиомечения.[139] Хотя соединения предлагаются для визуализации GhrR в головном мозге, они также могут быть использованы для обнаружения опухолевых клеток, экспрессирующих GhrR. Недавно группа Luyt также сообщила о производных хиназолинона, несущих фтор и нацеленных на GhrR, как потенциальных ПЭТ-трейсерах. Они продемонстрировали успешное радиомечение 18F двух своих ведущих соединений с высоким сродством к GhrR.[140]
5. Пептиды, нацеленные на рецепторы, как носители противоопухолевых препаратов
Пептидные лиганды являются крайне подходящим выбором для разработки лекарственных конъюгатов, нацеленных на рецепторы, связывающие пептиды (Таблица 1). Они обладают несколькими преимуществами в качестве молекул-носителей для доставки терапевтически активных соединений в раковые клетки. Пептидные лиганды обычно связываются с высокой аффинностью со своими целевыми рецепторами, что позволяет использовать низкие дозы пептидно-лекарственного конъюгата (PDC) для достижения эффективного терапевтического эффекта. Кроме того, пептиды обычно считаются безопасными, поскольку они обладают низкой иммуногенностью и производят нетоксичные метаболиты.[141] Наконец, пептиды длиной до 50 аминокислот могут быть легко синтезированы методом твердофазного пептидного синтеза и селективно модифицированы для создания PDC с улучшенными свойствами.[142] Недостатком пептидных лигандов как систем доставки препаратов может быть их низкая стабильность in vivo и короткий период полувыведения из-за быстрой деградации протеолитическими ферментами в крови и быстрого почечного клиренса.[143] Следовательно, естественные пептидные гормоны пептидных рецепторов часто требуют стабилизации. Это может быть достигнуто за счет модификации основной цепи и последовательности,[144] что часто используется для разработки PDC. Модификации включают, например, циклизацию (например, c(RGDfK), октреотид), N-метилирование и замену аминокислот на неестественные или D-аминокислоты (например, [d-Lys6]-GnRH-I, короткие агонисты GhrR). Другой важный подход для увеличения периода полувыведения пептидов для терапии — липидация.[145] Присоединенная жирнокислотная группа способна связываться с альбумином сыворотки человека в кровотоке, что оказывает защитное действие и приводит к увеличению времени циркуляции пептидного конъюгата.[146] Эта концепция впечатляюще демонстрируется на примере коммерчески доступных длительно действующих агонистов рецептора глюкагоноподобного пептида-1 (GLP-1) лираглутида (Victoza)[147] и семаглутида (Ozempic),[148] которые используются для лечения диабета 2 типа. Липидация может быть также полезна для создания PDC с увеличенным периодом полувыведения. Более длительная циркуляция PDC часто требуется для лечения солидных опухолей, чтобы обеспечить достаточное время для доставки и проникновения PDC в злокачественную ткань. Однако в некоторых случаях длительное нахождение PDC в кровотоке может вызывать более сильные побочные эффекты из-за длительного воздействия токсичного агента на ткани. В целом, настройка фармакокинетики PDC остается одной из основных проблем для клинического перевода этих молекул.
Таблица 1. Обзор рецепторов, связывающих пептиды, изученных для доставки противоопухолевых препаратов
Примечание: Приведены примеры пептидных лигандов, которые могут быть использованы для нацеливания на эти рецепторы, а также указана экспрессия рецепторов в опухолях человека.
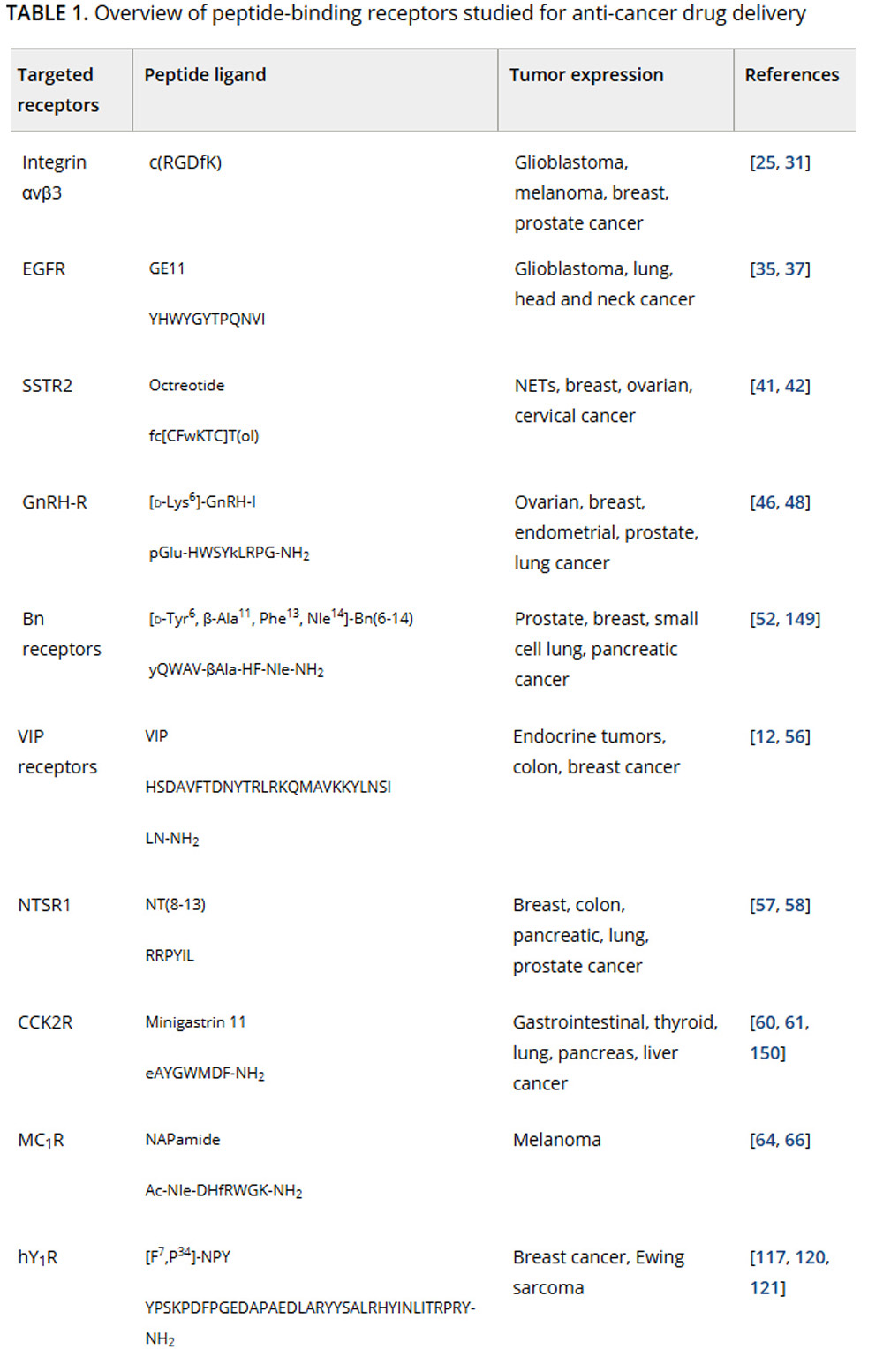
Сокращения:
- Ac – ацетил;
- Bn – бомбезин;
- c – циклический;
- CCK2R – холецистокининовый рецептор 2 типа;
- e – d-глутаминовая кислота;
- EGFR – рецептор эпидермального фактора роста;
- f – d-фенилаланин;
- GnRH-R – рецептор гонадотропин-рилизинг гормона;
- hY1R – человеческий Y1 рецептор;
- k – d-лизин;
- MC1R – меланокортиновый рецептор 1 типа;
- NET – нейроэндокринная опухоль;
- Nle – норлейцин;
- NPY – нейропептид Y;
- NT – нейротензин;
- NTSR1 – рецептор нейротензина 1 типа;
- pGlu – пироглутаминовая кислота;
- SSTR2 – соматостатиновый рецептор 2 типа;
- VIP – вазоактивный интестинальный пептид;
- w – d-триптофан;
- y – d-тирозин.
Помимо оптимизации стабильности пептида, также важно минимизировать влияние лекарственного соединения или терапевтически активного компонента на аффинность связывания и профиль селективности пептида. Пептиды предоставляют возможность включения лекарственного груза в определенные участки их последовательности с использованием различных химических стратегий.[142] Во многих случаях присоединение лекарственного соединения может быть выполнено просто на N-конце пептида, как, например, это делается для аналога соматостатина октреотида. Однако для некоторых пептидов, таких как короткие агонисты GhrR, это невозможно, поскольку сам N-конец участвует в связывании с рецептором.[101] В таких случаях последовательность пептида может быть проанализирована на наличие остатков лизина, цистеина, глутамата или серина, которые могут позволить модификацию боковой цепи лекарственным грузом без потери активности пептида в отношении рецептора. Кроме того, с помощью сканирования аминокислот можно идентифицировать боковые цепи в последовательности пептида, которые не являются критически важными для связывания с рецептором. В целом, понимание взаимодействия между пептидом и рецептором позволяет рационально ввести лекарственный груз. В идеальном случае пептидный носитель содержит несколько сайтов для конъюгации с грузом, что является одним из преимуществ пептидов по сравнению с малыми молекулами в качестве таргетингующих единиц. Все эти концепции недавно были реализованы в [F7,P34]-NPY, где, помимо естественного Lys4, определенные другие позиции были заменены на лизин и модифицированы без какого-либо влияния на активность и селективность пептида.[151]
Для PDC (пептидно-лекарственных конъюгатов) с химиотерапевтическими агентами и другими терапевтически активными грузами клеточный захват в раковые клетки, экспрессирующие рецептор, является необходимым условием для достижения внутриклеточной локализации лекарственного груза. После связывания и активации PDC должен интернализироваться в комплексе с рецептором. В то время как рецептор может рециклироваться обратно на плазматическую мембрану, PDC должен оставаться в эндосомах/лизосомах, и лекарственное или терапевтически активное соединение может оказывать свое действие внутри клетки. Особый интерес представляют рецепторы с быстрой кинетикой интернализации и сильным поведением рециклинга/оборота, такие как hY1R. В сочетании с мощным PDC это позволяет осуществлять многократные циклы доставки в раковые клетки и, следовательно, сильное накопление молекул препарата. Последнее часто требуется для достижения желаемого терапевтического эффекта, поскольку химиотерапевтические агенты часто обладают микромолярной активностью в отношении своих внутриклеточных мишеней, в то время как пептидные носители демонстрируют (суб)наномолярное сродство к своим рецепторам. Увеличение нагрузки пептидного носителя лекарственным грузом является одним из подходов к снижению необходимой дозы PDC, поскольку дозы, значительно превышающие необходимые для полной интернализации рецептора, могут привести к нежелательным побочным эффектам. Интернализация разработанного PDC также должна быть валидирована, поскольку модификация в целом может потенциально нарушить это свойство пептидного лиганда. Это было отмечено для аналогов hPP, нацеленных на hY4R, которые изучались как средства для лечения ожирения.[152] Аналоги hPP были липидированы или PEGилированы для увеличения их периода полувыведения in vivo. В то время как пептиды, модифицированные пальмитиновой кислотой, приводили к быстрой интернализации подтипа hY4R, PEG-модифицированные аналоги не вызывали интернализацию, несмотря на полную активацию рецептора. Интернализацию PDC можно исследовать косвенно, отслеживая флуоресцентно меченые версии целевых рецепторов. Специфическая интернализация hY1R под действием [F7,P34]-NPY была продемонстрирована на клеточных системах, стабильно или временно экспрессирующих различные подтипы hYR, слитые с аутофлуоресцентными белками.[153, 154] Это также еще раз иллюстрирует, что пептидный лиганд для PDC должен быть выбран с высокой селективностью к целевому рецептору в раковых клетках, поскольку рецепторы, связывающие пептиды, часто состоят из различных подтипов с разными профилями экспрессии в злокачественных и незлокачественных тканях.[12] Кроме того, клеточный захват PDC можно визуализировать напрямую, дополнительно пометив пептидный лиганд небольшим флуорофором. В сочетании с меченым рецептором это также позволяет исследовать ко-локализацию (Рисунок 5) и, следовательно, доказать рецептор-опосредованную внутриклеточную доставку PDC. Наконец, одной из неизвестных в интернализации PDC часто является внутриклеточная судьба лекарственного груза. Эндосомальный выход лекарственного груза или PDC остается неясным, а недостаточная доставка терапевтически активного компонента в субклеточные структуры или быстрый отток могут привести к снижению терапевтической эффективности. Дальнейшие исследования в этой области крайне необходимы для оптимизации эффектов PDC.
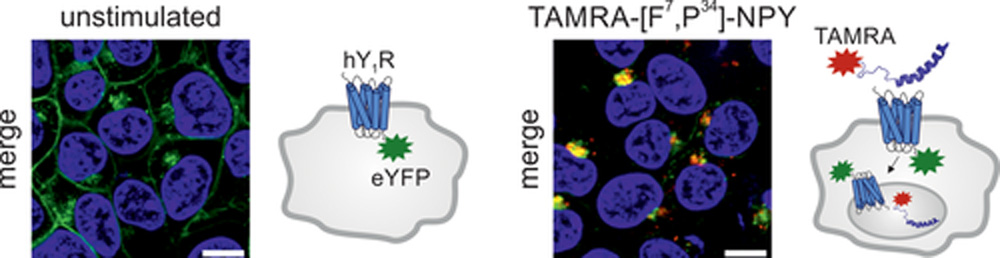
Рисунок 5
Пример изображений флуоресцентной микроскопии, демонстрирующих внутриклеточную доставку пептидного лиганда через рецептор-опосредованный эндоцитоз.
На изображениях показаны клетки HEK293, стабильно экспрессирующие человеческий Y1-рецептор (hY1R), C-терминально слитый с улучшенным желтым флуоресцентным белком (eYFP). Ядра клеток окрашены красителем Hoechst 33342 (синий цвет). В нестимулированном состоянии флуоресцентно меченый hY1R (зеленый цвет) преимущественно локализуется на плазматической мембране (левое изображение). После стимуляции в течение 1 часа флуоресцентно меченым лигандом TAMRA-[F7,P34]-NPY (красный цвет) наблюдается ко-локализация рецептора и пептидного лиганда во внутриклеточных везикулах (желтое наложение флуоресценции, правое изображение).
Обозначения:
- TAMRA: 6-карбокситетраметилродамин.
- Масштабная линейка: 10 мкм.
Этот эксперимент демонстрирует процесс рецептор-опосредованного эндоцитоза, при котором пептидный лиганд доставляется внутрь клетки через связывание с рецептором hY1R, что подтверждается ко-локализацией флуоресцентных сигналов рецептора и лиганда во внутриклеточных везикулах.
6. Вариации лекарственного груза в пептидно-лекарственных коньъюгатах, нацеленных на рецепторы
Вторая важная часть пептидно-лекарственного конъюгата (PDC) — это лекарственный груз. В классическом понимании термин «лекарство» в пептидно-лекарственном конъюгате относится к цитотоксическим (химиотерапевтическим) противоопухолевым агентам. Однако термин «лекарство» может включать более широкий спектр терапевтически активных компонентов, которые могут быть конъюгированы с пептидным лигандом. Модификация пептидов комплексом радионуклида в качестве лекарственного груза позволяет создавать таргетные радиофармацевтические препараты для пептидной рецепторной радионуклидной терапии. Кроме того, борсодержащие соединения могут использоваться в качестве груза для создания PDC для бор-нейтрон-захватной терапии.
6.1 Химиотерапевтические агенты
PDC для таргетной химиотерапии обычно состоят из пептидного носителя, расщепляемого линкера и токсичного агента. Токсичный агент выбирается таким образом, чтобы он был неактивен в своей конъюгированной форме, что делает PDC пролекарством, которое активируется только в опухолевой ткани.[155] Линкер должен быть ферментативно стабильным во время циркуляции в крови, чтобы избежать преждевременного высвобождения токсичного агента, что может привести к нежелательной периферической токсичности. После достижения раковых клеток линкер расщепляется внутриклеточно благодаря изменению биологической среды. Это высвобождает токсичный агент быстро и эффективно, позволяя ему оказывать свое токсическое действие на раковые клетки.
Для PDC были описаны различные стратегии линкеров. Один класс линкеров — это стимул-чувствительные, расщепляемые линкеры. Они разработаны для высвобождения препарата из PDC в микроокружении опухоли или в измененной внутриклеточной среде по сравнению с внеклеточным пространством. Например, кислотно-лабильные связи, такие как гидразон, имины, оксимы, ацетали или цис-аконитильные связи,[156] могут расщепляться при более низком pH (4,5–6,0) в эндосомах/лизосомах[157] после эндоцитозного захвата PDC. Кроме того, дисульфидные линкеры могут расщепляться внутри клеточных компартментов под действием восстановителей, таких как цистеин и глутатион.[158] Линкеры также могут быть разработаны с ферментативно расщепляемой единицей. Эфирные и карбаматные связи могут гидролизоваться эстеразами и цитохромом P450 после клеточного захвата.[159, 160] Наиболее часто используются сукцинильные и глутарильные линкеры, однако стабильность эфирных связей в крови должна тщательно контролироваться. Линкеры на основе пептидов, которые специфически расщепляются внутриклеточными протеазами после интернализации, вызывают значительный интерес. Пептидные связи в таких линкерах стабильны во время циркуляции,[161] но быстро гидролизуются протеазами в эндосомах или лизосомах, что делает их оптимальными структурами для разработки PDC для таргетной химиотерапии. Две часто используемые пептидные последовательности — это Val-Cit[162] и Gly-Phe-Leu-Gly (GFLG),[163] которые расщепляются протеазой катепсином B. Последний также был обнаружен в сверхэкспрессии при некоторых подтипах рака.[164] Еще одним перспективным классом линкеров для PDC являются так называемые саморазрушающиеся спейсеры. Этот тип спейсера используется в сочетании с другим расщепляемым линкером и позволяет высвобождать токсичный агент из PDC после одновременных каскадных реакций.[165]
Токсичный агент для PDC может быть выбран из большого пула доступных и хорошо зарекомендовавших себя химиотерапевтических препаратов. Однако выбранный препарат должен соответствовать определенным принципам проектирования, чтобы служить подходящим соединением для создания PDC. Он должен содержать внутреннюю функциональную группу, которая позволяет присоединить его к расщепляемому линкеру и, следовательно, к пептидному носителю. Свободные гидроксильные, карбоксильные или аминогруппы доступны во многих токсичных агентах и поэтому чаще всего используются для конъюгации (Рисунок 6). В случае, если функциональная группа необходима для биологической активности токсичного агента, линкер должен быть способен высвобождать токсофор без остатка.[155] Кроме того, препарат должен обладать достаточной и мощной цитотоксичностью в отношении злокачественных клеток, так как механизмы устойчивости раковых клеток могут быть проблемой.[166] Химиотерапевтические агенты для PDC можно классифицировать в соответствии с их общим механизмом действия.[167] Некоторые из них связываются или взаимодействуют с клеточной ДНК или ДНК-белковыми комплексами, блокируя транскрипцию и репликацию ДНК или вызывая повреждение ДНК. В конечном итоге все эти эффекты приводят к апоптозу целевой клетки. Примеры включают металлические комплексы,[168] камптотецин (CPT),[169] и антрациклины даунорубицин (DAU) и доксорубицин (DOX).[170] Другие токсичные агенты — это антиметаболиты, которые вмешиваются в биосинтез ДНК, например, гемцитабин как нуклеозидный аналог дезоксицитидина[171] и метотрексат (MTX) как антифолат, ингибирующий фермент дигидрофолатредуктазу.[172] Кроме того, в качестве токсичной нагрузки в PDC используются антимитотические агенты, действующие на микротрубочки. К ним относятся паклитаксел (PTX), который ингибирует деполимеризацию микротрубочек,[173] и группа алкалоидов барвинка, которые ингибируют полимеризацию тубулина.
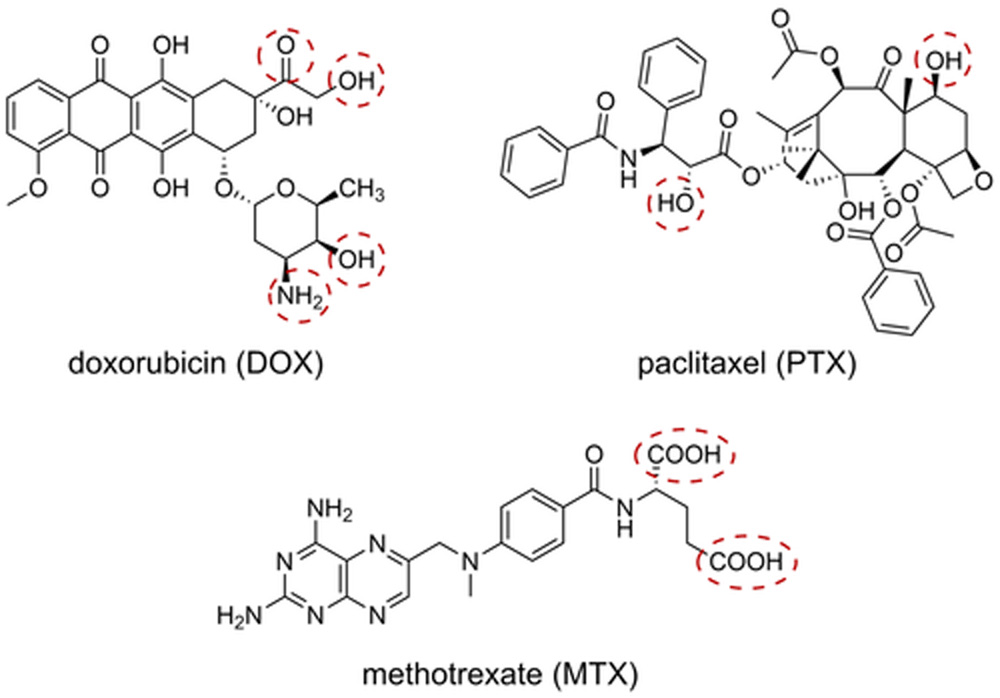
Рисунок 7
Химические структуры пептидно-лекарственных конъюгатов, нацеленных на рецепторы, которые достигли фазы 3 клинических исследований.
A. Зоптарелин доксорубицин (AEZS-108, AEterna Zentaris).
B. ANG1005 (Angiochem Inc.). PTX, паклитаксел.
Примечательно, что еще один PDC под названием ANG1005 (Angiochem Inc.) достиг фазы 3 клинических испытаний. ANG1005 состоит из пептида ангиопеп-2, способного проникать через гематоэнцефалический барьер (ГЭБ), конъюгированного с тремя молекулами паклитаксела (PTX) с помощью расщепляемых эфирных линкеров (Рисунок 7B).[195] Он способен преодолевать ГЭБ посредством рецептор-опосредованного трансцитоза после связывания с рецептором, связанным с липопротеинами низкой плотности 1 (LRP1), который сверхэкспрессируется при раке мозга.[196] ANG1005 показал более высокое поглощение в мозге по сравнению со свободным PTX и значительную противоопухолевую активность in vivo у мышей с глиобластомой.[195] В фазе 1 клинического испытания на пациентах с рецидивирующей или прогрессирующей злокачественной глиомой ANG1005 достиг терапевтических концентраций в месте опухоли и хорошо переносился.[197] Фазы 2 клинических испытаний на пациентах с рецидивирующими высокозлокачественными глиомами и пациентах с раком молочной железы с рецидивирующими метастазами в мозг были завершены, и результаты последнего исследования были недавно опубликованы.[198, 199] У большинства пациентов, получавших ANG1005, наблюдалось улучшение симптомов и увеличение общей выживаемости по сравнению с историческим контролем, особенно у пациентов с лептоменингеальным карциноматозом.[199] Фаза 3 исследования, направленного на изучение способности ANG1005 продлевать выживаемость пациентов с раком молочной железы с впервые диагностированным лептоменингеальным заболеванием, должна начаться в сентябре 2020 года.[200]
6.2 Радионуклиды
Радиомеченые пептидные лиганды в целом могут использоваться для двух основных целей, связанных с раком. Основная область их применения — это использование в качестве диагностических инструментов для визуализации экспрессии их целевых рецепторов в опухолевой ткани. Пептиды могут быть мечены позитрон-излучающими радиоизотопами, такими как 18F, медь-64 (64Cu) и галлий-68 (68Ga), для создания агентов для ПЭТ-визуализации. Кроме того, γ-излучающие радиоизотопы, такие как 99mTc и йод-123 (123I), используются для разработки пептидных агентов для однофотонной эмиссионной компьютерной томографии (ОФЭКТ). Информацию о пептидах, нацеленных на рецепторы, как молекулярных агентах для визуализации, можно найти в нескольких обзорах.[201, 202] Пептидные носители, меченные терапевтическим радионуклидом, также могут рассматриваться как PDC, где комплекс радионуклида представляет собой лекарственный груз. Эти конъюгаты представляют большую перспективу в качестве таргетных радиофармацевтических препаратов для пептидной рецепторной радионуклидной терапии (PRRT). В настоящее время ведется активная дискуссия относительно использования антагонистов и агонистов для пептидных радиофармацевтических препаратов. Антагонисты могут быть полезны, поскольку они не активируют целевой рецептор, что может снизить нежелательные побочные эффекты. Кроме того, сообщалось, что антагонисты распознают большее количество сайтов связывания рецепторов по сравнению с агонистами, что привело к более высокому поглощению опухолью и удержанию радиомеченых антагонистов in vivo.[203, 204] Недавно антагонист, нацеленный на SSTR, был оценен для PRRT в пилотном исследовании на четырех онкологических пациентах.[205] Поглощенные дозы радиации в опухоли и соотношения доз опухоль/почки и опухоль/костный мозг были выше для антагонистического соединения по сравнению с агонистом SSTR. Однако клинические испытания еще должны доказать, способны ли антагонисты превзойти агонисты. Кроме того, только рецептор-опосредованная интернализация, индуцированная агонистами, способствует избирательному накоплению радиоизотопов внутри опухолевых клеток, что крайне предпочтительно для определенных радиоизотопов для достижения усиленного эффекта в PRRT.
Радионуклиды для PRRT можно разделить на три основные категории: β−-излучатели, излучатели оже-электронов и α-излучатели.[206, 207] Выбор терапевтических радиометаллов представлен в Таблице 2.
Таблица 2. Характеристики выбранных терапевтических радиометаллов для пептидной рецепторной радионуклидной терапии
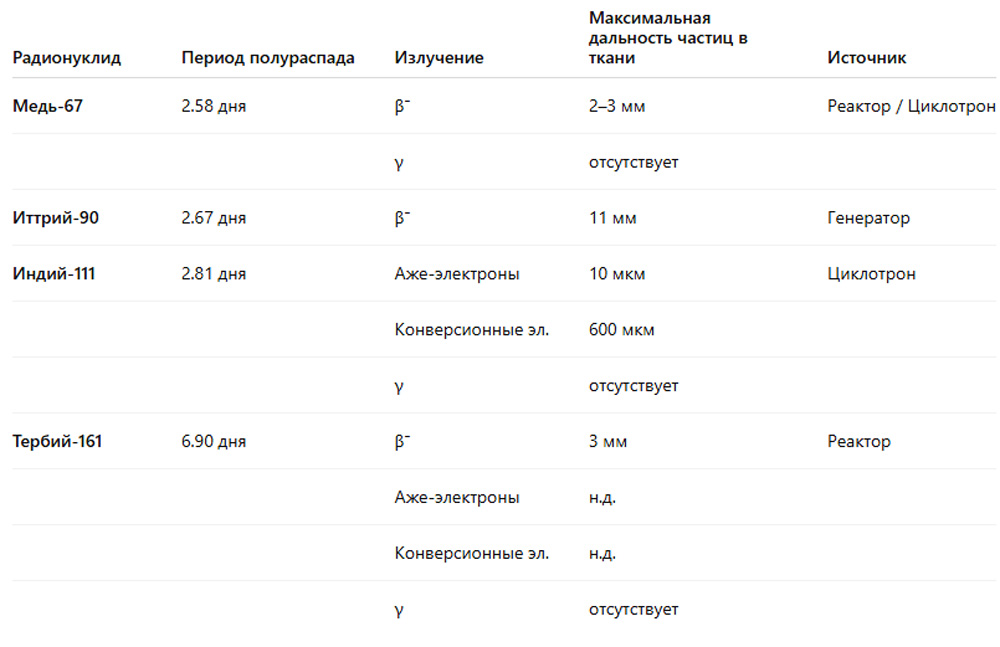
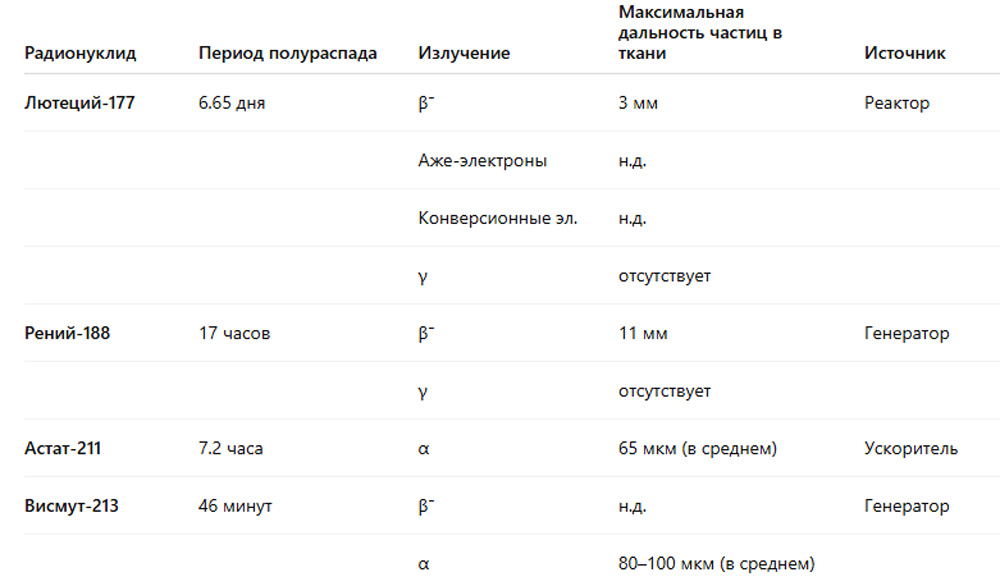
Из-за сильно различающихся характеристик типов излучения выбор радионуклида для пептидной рецепторной радионуклидной терапии (PRRT) во многом зависит от размера целевой опухоли или метастазов.[208] Одним из наиболее часто используемых радиометаллов для пептидных радиофармацевтических препаратов является чистый высокоэнергетический β−-излучатель иттрий-90 (90Y, максимальная энергия: 2,27 МэВ). β−-излучение 90Y имеет длинный диапазон проникновения в ткани — до 11 мм, что позволяет оказывать «перекрестный эффект» (cross-fire effect), то есть облучение опухолевых клеток, к которым пептид, содержащий 90Y, не связывается напрямую.[209] Это может быть полезно для компенсации неоднородности поглощения в крупных опухолях. Еще одним часто используемым радионуклидом для PRRT является среднеэнергетический β−-излучатель лютеций-177 (177Lu, максимальная энергия: 0,5 МэВ).[210] Помимо излучения β−-частиц с диапазоном проникновения в ткани до 3 мм, 177Lu также испускает определенное количество низкоэнергетических оже-электронов и конверсионных электронов (CE), которые высвобождают свою дозу на коротком расстоянии. Монте-Карло-симуляции предполагают, что 177Lu имеет более высокую скорость уничтожения мелких метастазов по сравнению с 90Y,[211] что подтверждается исследованием in vivo с радиомечеными конъюгатами антител, направленными против ксенотрансплантатов B-клеточной лимфомы у мышей.[212] Кроме того, 177Lu распадается с низкой интенсивностью γ-излучения, что позволяет проводить посттерапевтическую дозиметрию. Радиометалл индий-111 (111In) в основном используется для визуализации благодаря своему основному γ-излучению. Однако 111In также испускает оже-электроны и CE, что позволяет использовать его в качестве терапевтического радионуклида. Как симуляции, так и биологические исследования предполагают, что 111In может превосходить 177Lu в лечении микрометастазов (<100 мкм) и мелких клеток.[211-213] Недостатком 111In является его высокая доля дополнительного фотонного излучения, что увеличивает общую дозу для организма. Радионуклид, который недавно вызвал интерес для использования в PRRT, — это радиолантанид тербий-161 (161Tb).[214] 161Tb имеет схожий спектр среднеэнергетического β−-излучения с 177Lu, но испускает больше оже-электронов и CE, сочетая преимущества двух категорий терапевтических радионуклидов. Сравнимые с 111In симуляции предполагают, что 161Tb способен доставлять более высокие дозы к микрометастазам и отдельным клеткам по сравнению с 177Lu.[211] Два биологических исследования показали, что антитела против L1CAM и фолатные конъюгаты, меченные 161Tb, демонстрируют более эффективное подавление роста опухоли in vivo по сравнению с их аналогами, меченными 177Lu.[215, 216] Более того, преимущество 161Tb перед 111In заключается в излучении гораздо меньшего количества фотонов. Для радионуклидов, таких как 161Tb, с высоким излучением короткодействующих оже-электронов и CE в очень низкоэнергетической области (<50 кэВ), интернализация в опухолевые клетки желательна для улучшения терапевтического эффекта. Дополнительная доставка в ядро клетки облегчила бы максимальное высвобождение дозы в ДНК.[217] Наконец, использование α-излучателей в PRRT является относительно новым подходом, но ожидается, что оно будет развиваться в будущем. Излучение α-частиц создает высокую линейную передачу энергии (LET), что приводит к очень высокой цитотоксичности на клеточном уровне и короткому диапазону в тканях, что потенциально может снизить побочные эффекты. Перспективные α-излучатели для PRRT включают, среди прочих, висмут-213 (213Bi) и астат-211 (211At).[218]
Метка пептидного носителя терапевтическим радионуклидом может быть достигнута с помощью прямой стратегии, при которой функциональные группы в последовательности пептида используются для комплексообразования с радиометаллом. Это преимущественно применяется для радионуклида рений-188 (188Re).[219] Однако для большинства радиометаллов используется непрямая метка с помощью бифункционального хелатирующего агента (BFCA).[220, 221] BFCAs состоят из двух функциональных групп: хелатирующего блока для координации иона радиометалла и функциональной группы, которая позволяет ковалентно присоединить его к пептидному лиганду. Кроме того, существуют две категории BFCAs: ациклические хелаторы и макроциклические хелаторы. Наиболее часто используемым ациклическим BFCA для создания пептидных радиофармацевтических препаратов является диэтилентриаминпентауксусная кислота (DTPA),[220] которая может быть конъюгирована с пептидным носителем через свои карбоксильные группы (Рисунок 8A). DTPA характеризуется быстрой кинетикой связывания металлов, что позволяет быстро проводить радиомечение в мягких условиях. Однако основным недостатком является то, что комплексы DTPA с наиболее часто используемыми β−-излучающими радиометаллами обладают недостаточной стабильностью in vivo.[222] Из группы макроциклических хелаторов наиболее часто применяемым BFCA для конъюгации с пептидами является 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (DOTA) (Рисунок 8B).[223] DOTA предоставляет восемь донорных атомов и подходящий размер полости для комплексообразования с различными трехвалентными радиометаллами и лантанидами, требующими высокого координационного числа. Она может быть присоединена к пептидам через одну из своих карбоксильных групп. Хотя кинетика мечения DOTA довольно медленная, этот BFCA образует термодинамически и кинетически стабильные комплексы с радиометаллами, которые выдерживают конкурирующую среду в биологической системе, что делает его высоко подходящим для разработки радиомеченых пептидов.[222] Введение радионуклида в пептиды обычно выполняется с помощью подхода пост-мечения. Здесь BFCA сначала ковалентно присоединяется к пептиду во время твердофазного синтеза. Для DOTA это, например, возможно с использованием защищенного строительного блока DOTA-трис(трет-бутиловый эфир). После этого радиомечение осуществляется простым взаимодействием очищенного BFCA-пептида с раствором соли радиометалла.
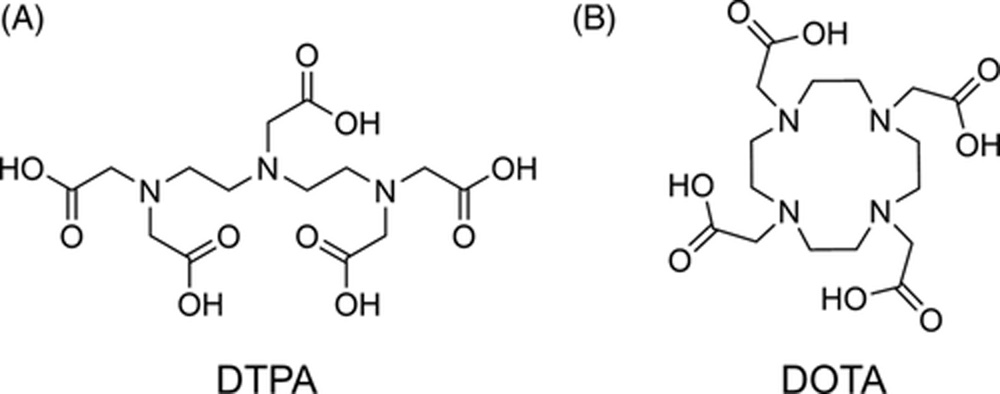
Рисунок 8
Химические структуры ациклического хелатора диэтилентриаминпентауксусной кислоты (DTPA) (A) и макроциклического хелатора 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты (DOTA) (B).
Высокий интерес к пептидной рецепторной радионуклидной терапии (PRRT) тесно связан с успехом радиомеченых аналогов соматостатина, нацеленных на соматостатиновые рецепторы (SSTR). 111In-DTPA-октреотид (Октреоскан) стал первым одобренным пептидным радиофармацевтическим препаратом для диагностической визуализации нейроэндокринных опухолей (НЭО), положительных по SSTR, и также ознаменовал начало PRRT.[224] Введение высокой дозы 111In-DTPA-октреотида пациентам с метастазирующими НЭО привело к паллиативному эффекту, но регрессия размера опухоли была неудовлетворительной.[225] Это было связано с короткодействующим излучением оже-электронов 111In, что не идеально для макроскопических опухолей. Во втором поколении терапевтических радиофармацевтических препаратов, нацеленных на SSTR, были изменены пептидный носитель, BFCA и радионуклид. Сначала использовался аналог соматостатина [Tyr3]-октреотид с более высоким сродством к SSTR2, который был N-терминально конъюгирован с макроциклическим хелатором DOTA.[226] Полученный [DOTA0,Tyr3]-октреотид (DOTA-TOC) был радиомечен 90Y. Начиная с конца 1990-х годов, 90Y-DOTA-TOC исследовался в многочисленных клинических испытаниях и показал значительно улучшенную терапевтическую эффективность у пациентов с НЭО по сравнению с 111In-DTPA-октреотидом.[227, 228] Дальнейшая оптимизация была выполнена путем замены C-терминального треонинола в DOTA-TOC на треонин, что привело к созданию пептидного конъюгата [DOTA0,Tyr3]-октреотата (DOTA-TATE) с девятикратно увеличенным сродством к SSTR2 по сравнению с DOTA-TOC.[229] 90Y-DOTA-TATE исследовался в фазе 2 клинического исследования у пациентов с гастроэнтеропанкреатическими (ГЭП) НЭО.[230]
Наиболее успешным терапевтическим пептидным радиофармацевтическим препаратом на сегодняшний день является 177Lu-DOTA-TATE (Рисунок 9). PRRT с этим конъюгатом широко исследовалась в нескольких клинических испытаниях в европейских центрах.[231] В целом, частичный или полный ответ наблюдался примерно у 30% пациентов с НЭО, а медиана выживаемости без прогрессирования составила около 36 месяцев. Кроме того, первые результаты фазы 3 исследования NETTER-1 в начале 2017 года показали, что PRRT с 177Lu-DOTA-TATE привела к более длительной выживаемости без прогрессирования и значительно более высокой частоте ответа по сравнению с высокодозным октреотидом пролонгированного действия у пациентов с распространенными НЭО средней кишки.[232] В октябре 2017 года Европейская комиссия одобрила 177Lu-DOTA-TATE (Лютатера) для лечения неоперабельных или метастатических, прогрессирующих ГЭП-НЭО, положительных по SSTR, у взрослых. Одобрение FDA последовало в январе 2018 года.
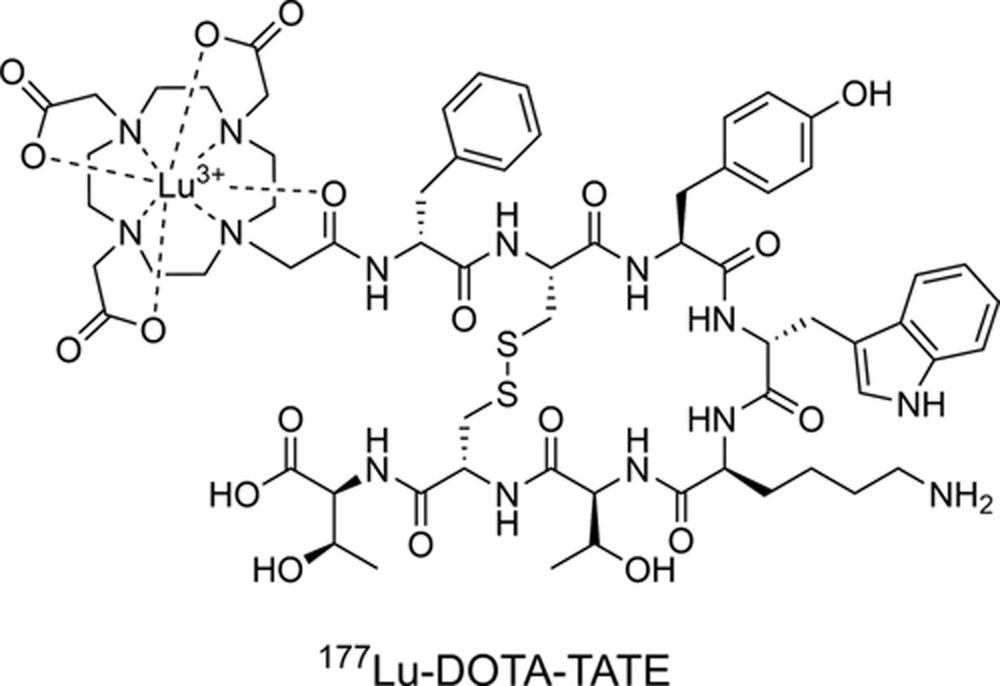
Рисунок 9
Химическая структура 177Lu-DOTA-TATE, одобренного в ЕС для пептидной рецепторной радионуклидной терапии неоперабельных или метастатических, прогрессирующих ГЭП-НЭО, положительных по SSTR, у взрослых.
ГЭП-НЭО, гастроэнтеропанкреатическая нейроэндокринная опухоль; SSTR, соматостатиновый рецептор.
Помимо успеха с радиомечеными аналогами соматостатина, другие пептиды, нацеленные на рецепторы, находятся на различных стадиях разработки для PRRT. Димерный пептидный конъюгат 90Y-DOTA-E-[c(RGDfK)]2 для таргетинга интегринов был разработан и показал ингибирование роста опухоли у мышей с ксенотрансплантатами рака яичников.[233] Однако в последующем исследовании не было отмечено улучшения терапевтической эффективности этого соединения при фракционировании дозы.[234] Включение PEG-линкеров в 90Y-DOTA-PEG4-E-[PEG4-c(RGDfK)]2 привело к созданию конъюгата, который показал эффективное ингибирование роста глиом у мышей при низкой радиотоксичности в нормальных органах.[235] Для таргетинга бомбезиновых рецепторов в PRRT пептид 177Lu-DOTA-8-AOC-Bn(7-14)-NH2 исследовался на модели мышей с ксенотрансплантатами рака простаты (PC-3) и продемонстрировал значительное подавление роста опухоли.[236] Кроме того, был разработан пептидный носитель DO3A-CH2CO-G-4-аминобензоил-QWAVGHLM-NH2 (AMBA), связывающийся с бомбезиновыми рецепторами. Лечение мышей с опухолями PC-3 с использованием 177Lu-AMBA продлило их выживаемость и ингибировало рост опухоли.[237] Пептидный конъюгат 188Re-(Arg11)CCMSH, нацеленный на MC1R, где CCMSH представляет собой [Cys3,4,10,d-Phe7]α-MSH3-13, изучался для PRRT на модели мышей с меланомой человека.[238] По сравнению с контрольной группой у обработанных мышей наблюдалось значительное уменьшение размера опухоли и увеличение средней выживаемости. Наконец, радиомеченые аналоги NPY были предложены для таргетинга hYR в PRRT. Предпочитающий hY1R [F7,P34]-NPY был конъюгирован с хелатором DOTA через боковую цепь Lys4 и радиомечен 111In.[239] Полученный конъюгат [K4(DOTA-111In),F7,P34]-NPY сохранил аффинность связывания с hY1R in vitro и показал некоторое поглощение опухолью in vivo у мышей с опухолями MCF-7. Недавно был разработан многофункциональный конъюгат [F7,P34]-NPY, содержащий внутриклеточно высвобождаемую единицу DOTA-ядерной локализационной последовательности (NLS).[234] Конъюгат был мечен природным тербием-159 и сохранил активность и селективность в отношении hY1R. Кроме того, было выполнено радиомечение 111In в качестве суррогата радиолантанидов. Радиомеченый пептид специфически интернализировался в клетки MCF-7 и демонстрировал зависящее от времени ядерное поглощение 111In. Эти результаты показали, что многофункциональный конъюгат NPY представляет собой перспективную концепцию для селективной ядерной доставки радиолантанидов, излучающих оже-электроны, таких как 161Tb.
6.3 Борсодержащие соединения для БНЗТ
Пептиды, нацеленные на рецепторы, также могут быть конъюгированы с особыми лекарственными грузами для использования в терапии рака следующего поколения, требующей новых агентов доставки. Это относится к бор-нейтрон-захватной терапии (БНЗТ).
Идея БНЗТ была впервые описана Г. Л. Лохером еще в 1936 году. Сначала борсодержащее соединение накапливается в раковых клетках, после чего следует локальное облучение опухоли тепловыми или эпитепловыми нейтронами (Рисунок 10). Изотоп 10B, который составляет 19,9% природного бора, обладает чрезвычайно высоким сечением захвата нейтронов. Захват нейтрона 10B приводит к реакции деления [10B(1n,α)7Li], в результате чего образуются α-частицы и ядра лития-7 (7Li) с высокой линейной передачей энергии (LET). Поскольку эти LET-частицы высвобождают свою ионизирующую энергию на коротком расстоянии от 5 до 10 мкм, что соответствует диаметру клетки, их разрушительный эффект ограничивается клетками, содержащими бор.[240, 241] В принципе, БНЗТ предлагает возможность сочетать молекулярный таргетинг лекарств с региональным позиционированием пучка лучевой терапии для достижения двойного селективного терапевтического эффекта.[242] Клинические исследования БНЗТ в основном проводились на пациентах с рецидивирующим раком головы и шеи, высокозлокачественными глиомами и распространенной меланомой.[243] Несмотря на некоторые многообещающие результаты, до сих пор не удалось установить БНЗТ как жизнеспособный метод лечения рака в клинической практике из-за отсутствия оптимальных агентов доставки бора для БНЗТ.[244] Требования к таким соединениям включают: (a) доставку высоких количеств бора в опухоль (20-40 мкг 10B/г опухоли) для обеспечения достаточного образования разрушительных LET-частиц; (b) селективное поглощение бора опухолью с соотношением концентраций опухоль/нормальные клетки и опухоль/кровь >3:1 для защиты неопухолевой ткани; (c) низкую внутреннюю цитотоксичность; и (d) быстрое выведение из крови, но длительное удержание в опухоли. Предпочтительно, чтобы агент БНЗТ также доставлял необходимое количество бора в раковые клетки (не менее 10^9 атомов 10B на клетку) для обеспечения максимального высвобождения дозы в ДНК.[245] В настоящее время в клинических испытаниях используются только два борсодержащих препарата: l-борфенилаланин (BPA)[246] и натриевая соль меркаптоундекагидро-клозо-додекабората (BSH)[247] (Рисунок 11A). BPA чаще всего применяется в виде аддукта с фруктозой для увеличения его растворимости в воде.[248] В то время как предполагается, что BPA проникает в раковые клетки через L-тип аминокислотного транспортера,[249] BSH пассивно накапливается в опухолевой ткани.[250] Однако оба соединения имеют несколько недостатков. BPA содержит только один атом бора и должен вводиться в очень высоких дозах для достижения необходимого количества бора в опухоли. BSH не способен проникать через клеточную мембрану из-за своего заряда. Кроме того, оба соединения характеризуются довольно скромной селективностью к опухоли и, следовательно, демонстрируют субоптимальную эффективность БНЗТ.[251]
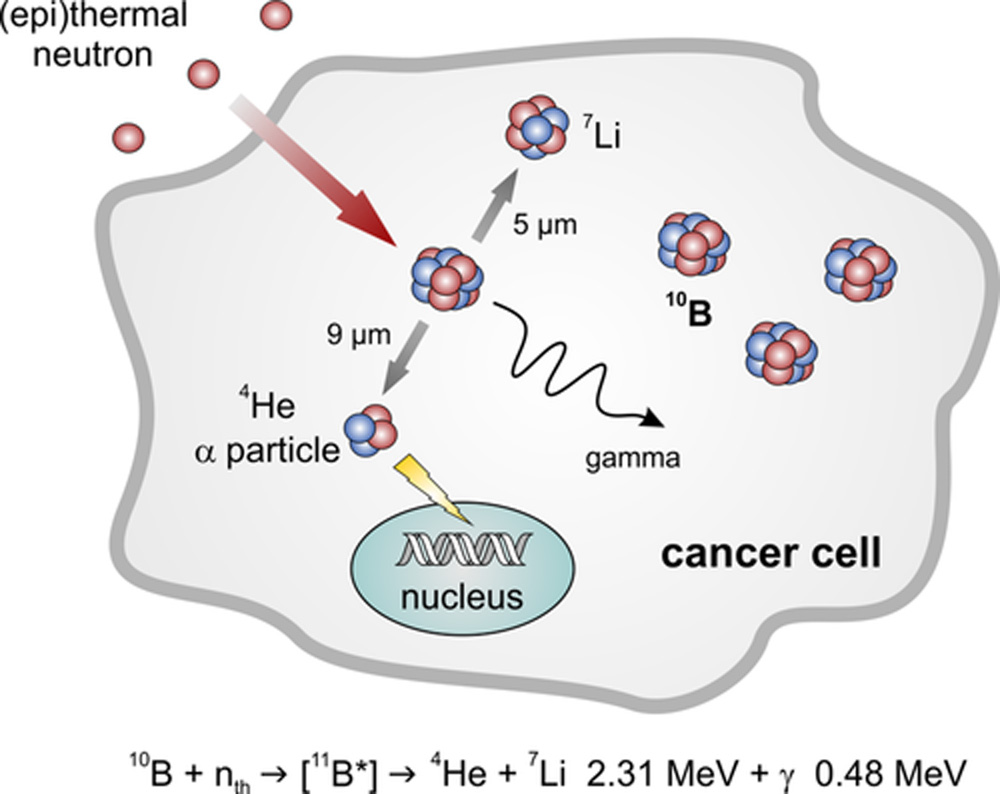
Рисунок 10
Схематическое представление реакции захвата нейтронов в бор-нейтрон-захватной терапии (БНЗТ).
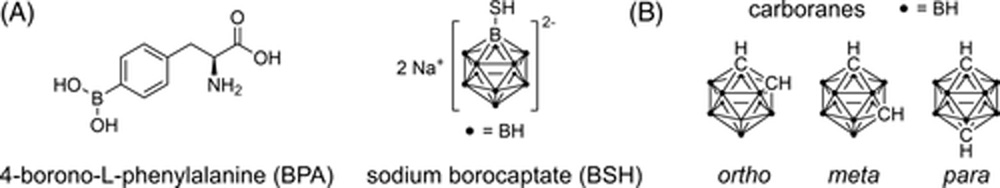
Рисунок 11
A. Структуры l-борфенилаланина (BPA) и натриевой соли борокаптата (BSH). Эти два соединения являются единственными борсодержащими препаратами, которые использовались для БНЗТ в клинических испытаниях.
B. Химические структуры орто-, мета- и пара-карборановых изомеров.
В поисках новых агентов для БНЗТ с более высокой селективностью к опухолям было разработано множество борсодержащих низкомолекулярных соединений, таких как производные нуклеозидов, аминокислот, сахаров и порфиринов.[251, 252] Кроме того, были созданы высокомолекулярные соединения, которые позволяют значительно увеличить содержание бора. К ним относятся, например, полианионные и поликатионные полимеры, полиамины, конъюгаты белков и антител, а также борсодержащие липосомы и наночастицы.[251, 252] Таргетинг рецепторов в БНЗТ активно изучался для EGFR при глиобластоме. Сильно борсодержащий полиамидоаминовый дендример (около 1000 атомов бора) был связан с лигандом EGF,[253, 254] а также с моноклональными антителами цетуксимабом[255, 256] и L8A4,[257, 258], где последние два нацелены на дикий тип EGFR или мутантный изоформу EGFRvIII соответственно. В качестве модели in vivo использовались крысы с глиомами F98, трансфицированными геном, кодирующим человеческий EGFR или EGFRvIII. Биоконъюгаты вводились методом конвекционно-усиленной доставки в глиомы крыс, после чего проводились эксперименты по БНЗТ. Было отмечено двукратное увеличение средней выживаемости (MST) крыс по сравнению с облученными контрольными животными, когда биоконъюгаты сочетались с внутривенным введением BPA.[259] Кроме того, крысы с композитной опухолью (1:1 F98EGFR + F98EGFRvIII клетки глиомы) лечились смесью борсодержащего цетуксимаба и L8A4 или индивидуально каждым антителом перед нейтронным облучением. Значительно более высокая MST была обнаружена у крыс в группе с совместным введением, что указывает на необходимость таргетинга обоих вариантов рецепторов для оптимального терапевтического эффекта в композитных опухолях.[259]
Для создания PDC в качестве потенциальных агентов доставки бора подходят карбораны. Эти икосаэдрические, гидрофобные кластеры C2B10H12 имеют высокое содержание бора и занимают относительно небольшой объем, немного больше, чем вращающееся фенильное кольцо.[260] Существуют три различных изомера, которые определяются положением атомов углерода в кластере (Рисунок 11B). Кроме того, вершины карборанового кластера могут быть химически функционализированы, что позволяет легко конъюгировать их с пептидами с помощью пептидной химии. Карбораны также демонстрируют высокую биологическую стабильность и относительно низкую цитотоксичность.[261]
Концепция PDC, содержащих карбораны, для БНЗТ была описана в нескольких исследованиях. Кимура и соавт. сообщили о разработке димерного PDC для таргетинга интегринов.[262] Два атома углерода кластера 1,2-дикарба-клозо-додекаборана(12) (орто-карборан) были связаны с циклическим пептидом c(RGDfK) через линкер из масляной кислоты (Рисунок 12A). Полученный конъюгат, названный GPU-201, продемонстрировал высокую аффинность связывания с интегрином αvβ3, дозозависимое поглощение опухолью у мышей с плоскоклеточной карциномой (SCCVII) и более длительное удержание в опухоли по сравнению с BSH. В последующем исследовании 10B-обогащенный GPU-201 был исследован в экспериментах по БНЗТ на мышах с SCCVII.[263] GPU-201 показал более сильное ингибирование роста опухоли по сравнению с BSH после нейтронного облучения, однако PDC также был более токсичным, чем BSH, как для пролиферирующих, так и для покоящихся раковых клеток без облучения. Ширмахер и соавт. впервые предложили использование интернализирующих PDC, нацеленных на GPCR, для БНЗТ, что позволило бы высокоселективную доставку бора в раковые клетки.[264] Они использовали [Tyr3]-октреотат (TATE), нацеленный на SSTR2, и модифицировали его N-терминально производным орто-карборана 5,6-дикарба-клозо-додекаборанил гексиновой кислоты. Кроме того, Миер и соавт. сообщили о конъюгации BSH с N-терминально модифицированным малеимидом TATE путем реакции Михаэля.[265] Однако для обоих конъюгатов биологическая активность не была определена.
Рисунок 12
Химические структуры:
A. Димерного конъюгата карборан-c(RGDfK) GPU-201 для таргетинга интегрина αvβ3.
B. Двойного карборанового модифицированного [Tyr3]-октреотата (TATE) для таргетинга SSTR2.
Бетцель и соавт. описали первые биологические тесты борсодержащих аналогов TATE.[266] В их PDC орто-карборановый строительный блок 4-(O-метиленкарборанил)-бензойная кислота (BBB1) был непосредственно связан с N-концом TATE или присоединен через глицин-саркозиновые спейсеры с одной, тремя или пятью единицами саркозина. Кроме того, две молекулы BBB1 были N-терминально конъюгированы с TATE через лизин-саркозиновые спейсеры с одной или тремя единицами саркозина (Рисунок 12B). Все моно-карборановые конъюгаты со спейсером демонстрировали наномолярную аффинность к SSTR2 независимо от длины спейсера. Для двойного карборанового конъюгата TATE требовался тройной саркозиновый спейсер для достижения подходящей аффинности к SSTR2. Дальнейшая фармацевтическая разработка борсодержащих пептидов, нацеленных на SSTR2, не проводилась.
Модификация нового гексапептидного суперагониста GhrR различными моно-карборановыми кластерами была оценена, и мета-карборан с линкером меркаптоуксусной кислоты был признан оптимальным благодаря своей высокой химической стабильности и подходящей эффективности активации GhrR конъюгатом.[267] Введение этого мета-карборана в известные лиганды рецептора грелина GHRP-6 и ипаморелин привело к созданию богатых бором пептидных конъюгатов с высокой активностью, которые специфически доставлялись в клетки через GhrR-опосредованный эндоцитоз.
Бор-модифицированные аналоги NPY для таргетинга hYR в БНЗТ были недавно описаны. Аминокислота Fmoc-Lys-Nε(Cpa)-OH, содержащая орто-карборанилпропионовую кислоту (Cpa), была включена в позицию 4 NPY, предпочитающего hY1R [F7,P34]-NPY и селективного к hY2R [Ahx(5-24)]-NPY во время твердофазного пептидного синтеза.[154] Модификация карбораном привела лишь к незначительной потере аффинности и активности конъюгатов NPY к hY1R и/или hY2R. Кроме того, селективность [K4(Cpa),F7,P34]-NPY и [K4(Cpa),Ahx(5-24)]-NPY была сохранена, что также было продемонстрировано индукцией специфической для подтипа hYR интернализации. Кроме того, орто-карборановый строительный блок 9-(карбоксиметилтио)-1,2-дикарба-клозо-додекаборан(12) был присоединен к боковой цепи остатков лизина в различных позициях в [F7,P34]-NPY.[151] Конъюгаты с модификацией карбораном в позициях 4, 18 или 22 в пептидной последовательности демонстрировали высокую активность в отношении hY1R, и эти позиции были объединены для создания тройного карборанового пептида. Полученный богатый бором аналог [F7,P34]-NPY показал наномолярную активность в отношении hY1R, селективность против других подтипов hYR и способность доставлять достаточное количество бора для БНЗТ в клетки HEK293, трансфицированные hY1R. В третьем исследовании дезоксигалактозил-функционализированный, зарядово-компенсированный кобальт бис(дикарболид) с повышенной гидрофильностью был конъюгирован с Lys4 в [F7,P34]-NPY, и была отмечена сохраненная активность конъюгата в отношении hY1R.[268] Конъюгаты [F7,P34]-NPY с максимальной нагрузкой бора также были разработаны.[269, 270] Галактозил-мета-карборан позволил создать пептид с восемью включенными карборановыми кластерами, то есть 80 атомами бора на молекулу пептида. Богатый бором конъюгат демонстрировал высокую активацию и интернализацию hY1R, селективность против других подтипов hYR и низкую внутреннюю цитотоксичность. Замена моно-галактозил-карборанов на бис-галактозил-карбораны в итоге привела к созданию 80-борного конъюгата NPY с высокой растворимостью в водных растворах и хорошей активностью в отношении hY1R. Этот новый препарат можно считать перспективным селективным агентом для БНЗТ.[270]
Примечательно, что два исследования описывают разработку бор-модифицированных пептидных конъюгатов, которые не нацелены на клеточные поверхностные рецепторы. Мичиуэ и соавт. использовали полиаргининовый (11R) клеточно-проникающий пептид (CPP) в качестве носителя и связали его с пептидным дендримером, содержащим восемь молекул BSH.[271] Полученный конъюгат 8BSH-11R обеспечил доставку высоких количеств бора (около 5000 ppm/10^6 клеток) в клетки глиомы U87ΔEGFR. В экспериментах по БНЗТ in vitro обработка 8BSH-11R перед нейтронным облучением привела к значительно более сильному ингибированию роста клеток глиомы U87ΔEGFR по сравнению с обработкой BSH. Кроме того, наблюдалось накопление 8BSH-11R в имплантированных клетках глиомы у мышей без поглощения в нормальном мозге. Во втором исследовании та же группа дважды модифицировала аргининовый трипептид (3R) с помощью BSH и хелатора DOTA.[272] Подобно ранее описанному конъюгату 11R, BSH-3R-DOTA специфически накапливался в имплантированных клетках глиомы U87ΔEGFR у мышей, и не было обнаружено поглощения в нормальных клетках мозга. Кроме того, радиомечение BSH-3R-DOTA с помощью 64Cu позволило количественно оценить поглощение у мышей с глиомой с помощью ПЭТ-визуализации. Для меченого конъюгата 3R наблюдались значительно более высокие соотношения накопления радиоизотопов опухоль/нормальный мозг и опухоль/кровь по сравнению с BSH-DOTA-64Cu.
7. Заключение и перспективы
Высокая сверхэкспрессия рецепторов, связывающих пептиды, в опухолях человека делает их перспективными мишенями для селективной доставки противоопухолевых препаратов. Синтетические аналоги естественных пептидных лигандов представляют большой интерес в качестве таргетингующих единиц, поскольку они обладают высокой аффинностью и специфичностью к мишени, быстрой скоростью интернализации и низкой иммуногенностью. Кроме того, возможна легкая химическая функционализация различными терапевтическими грузами. С одобрением 177Lu-DOTA-[Tyr3]-октреотата первый пептидный конъюгат для терапии рака, нацеленный на рецепторы, наконец достиг рынка. Однако перевод пептидно-лекарственных конъюгатов из лаборатории в клинику остается серьезным препятствием.
В отличие от конъюгатов антител с лекарствами, низкая стабильность в плазме и короткий период полувыведения PDC по-прежнему являются значительными проблемами для их клинической разработки. Особенно для лечения солидных опухолей требуется длительная циркуляция PDC, чтобы обеспечить достаточное проникновение конъюгата в злокачественную ткань. Однако современный химический инструментарий стратегий модификации пептидов для повышения стабильности и продления периода полувыведения сделал эти слабости PDC управляемыми. Настройка фармакокинетики PDC для обеспечения достаточного времени для терапевтического эффекта при избежании чрезмерного воздействия на незлокачественные ткани лекарственного груза (токсичного агента или радионуклида) имеет большое значение. Другой важной задачей для клинической разработки PDC, нацеленных на рецепторы, является достижение желаемой селективной терапевтической эффективности в опухолевой ткани. Абсолютная селективность PDC, естественно, является недостижимой целью, поскольку большинство целевых рецепторов, сверхэкспрессируемых на раковых клетках, также обнаруживаются в других неопухолевых тканях. Тем не менее, PDC могут предложить значительное улучшение терапевтического индекса, что, например, позволяет увеличить дозировку для устранения метастазов. Для оптимальной терапевтической эффективности PDC должны сильно накапливаться в опухолевых клетках, особенно когда в качестве лекарственного груза используются токсичные агенты и борсодержащие соединения для БНЗТ. Для разработки PDC необходимо использовать пептидные носители с высокой активностью в отношении целевого рецептора, чтобы можно было применять дозировочный режим, который позволяет максимальную интернализацию PDC в опухолевые клетки, сверхэкспрессирующие рецептор, но предотвращает токсичность и побочные эффекты в незлокачественных тканях. В случае химиотерапевтических агентов в качестве лекарственного груза желательна разработка и использование токсофоров с очень высокой активностью в отношении их внутриклеточной мишени для дальнейшего улучшения терапевтического индекса таких PDC. Увеличение лекарственной нагрузки PDC путем химической функционализации одного пептидного носителя несколькими молекулами препарата является еще одним потенциальным решением для повышения эффективности PDC in vivo. Наконец, важной задачей, связанной с интернализацией PDC, является внутриклеточная судьба лекарственного груза. Современные знания о эндосомальном выходе и внутриклеточной локализации интернализованных PDC/лекарственных грузов ограничены, но для многих терапевтически активных компонентов оптимизация субклеточной доставки привела бы к повышению терапевтической эффективности (например, радионуклиды, излучающие оже-электроны). Кроме того, степень метаболизма лекарственного груза внутри раковых клеток часто неясна, а сильный отток лекарственного груза несет риск воздействия на ненацеленные ткани. Новые знания во всех этих аспектах внутриклеточной биохимии позволят дальнейшую оптимизацию PDC.
Несмотря на упомянутые проблемы, сочетание современных химических и биологических знаний привело к прогрессу нескольких PDC для установленных целевых рецепторов в клинических исследованиях. Наконец, поскольку многие рецепторы, такие как рецептор грелина и Y1-рецептор, все еще ждут более глубокого изучения в качестве мишеней при раке, пептидно-лекарственные конъюгаты, нацеленные на рецепторы, имеют потенциал дать новые импульсы для терапии рака в будущем.
8. Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Биографии

Деннис Дж. Ворм получил степень бакалавра биохимии в Университете Тюбингена (Германия) в 2012 году и степень магистра биохимии в Рурском университете Бохума (Германия) в 2014 году. Затем он присоединился к лаборатории Бек-Зикингер в Лейпцигском университете (Германия), где занимался разработкой новых пептидно-лекарственных конъюгатов, нацеленных на GPCR, для продвинутой терапии рака. Он получил степень доктора философии (PhD) по химии в Лейпцигском университете в 2018 году и в настоящее время является постдокторантом-исследователем в Имперском колледже Лондона (Великобритания).

Сильвия Эльс-Хайндл — научный сотрудник Лейпцигского университета (Германия). Она изучала химию в рамках бакалаврской и магистерской программ в Лейпцигском университете и присоединилась к группе Аннетт Бек-Зикингер в 2009 году для работы над докторской диссертацией, посвященной пептидным лигандам рецептора грелина. Она получила степень доктора наук в 2013 году. Ее исследования включают изучение взаимодействий лиганд-рецептор и разработку пептидов в качестве терапевтических средств. В 2015 году она была удостоена премии доктора Берта Л. Шрама на Американском симпозиуме по пептидам.

Аннетт Г. Бек-Зикингер — профессор биохимии и биоорганической химии в Лейпцигском университете (Германия). Ее основные области исследований включают изучение взаимосвязей структура-активность пептидных/белковых гормонов и G-белок-связанных рецепторов. В своей работе она применяет тесно связанные методы биоорганического синтеза, молекулярной биологии и клеточной биохимии для идентификации новых мишеней, разработки новых терапевтических концепций и инновационных подходов в биоматериалах. Она была удостоена множества наград, включая премию Леонидаса Зерваса Европейского пептидного общества, золотую медаль Макса-Бергманн-Крейса (2009), премию Альбрехта Косселя по биохимии от GDCh (2018) и премию Дю Виньо Американского пептидного общества (2019). Она является членом Национальной академии наук Леопольдина в Германии и была награждена Саксонским орденом за заслуги в 2017 году.
Источники литературы
- World Health Organization, The global burden of disease: 2004 update, WHO, Geneva 2008.
- American Cancer Society, Global Cancer Facts & Figures, 3rd ed., ACS, Atlanda, GA 2015.
- L. A. Torre, F. Bray, R. L. Siegel, J. Ferlay, J. Lortet-Tieulent, A. Jemal, Cancer J. Clin. 2015, 65, 87.
- K. Strebhardt, A. Ullrich, Nat. Rev. Cancer 2008, 8, 473.
- T. Baudino, Curr. Drug Discov. Technol. 2015, 12, 3.
- J. K. Vasir, V. Labhasetwar, Technol. Cancer Res. Treat. 2005, 4, 363.
- M. Bhat, N. Robichaud, L. Hulea, N. Sonenberg, J. Pelletier, I. Topisirovic, Nat. Rev. Drug Discov. 2015, 14, 261.
- S. X. Pfister, A. Ashworth, Nat. Rev. Drug Discov. 2017, 16, 241.
- R. J. DeBerardinis, N. S. Chandel, Sci. Adv. 2016, 2, e1600200.
- Y. Kato, S. Ozawa, C. Miyamoto, Y. Maehata, A. Suzuki, T. Maeda, Y. Baba, Cancer Cell Int. 2013, 13, 89.
- I. Vhora, S. Patil, P. Bhatt, R. Gandhi, D. Baradia, A. Misra, Ther. Delivery 2014, 5, 1007.
- J. C. Reubi, Endocr. Rev. 2003, 24, 389.
- D. Böhme, A. G. Beck-Sickinger, J. Pept. Sci. 2015, 21, 186.
- E. I. Vrettos, G. Mező, A. G. Tzakos, Beilstein J. Org. Chem. 2018, 14, 930.
- C. S. Kue, A. Kamkaew, K. Burgess, L. V. Kiew, L. Y. Chung, H. B. Lee, Med. Res. Rev. 2016, 36, 494.
- P. J. Carter, P. D. Senter, Cancer J. 2008, 14, 154.
- L. Bildstein, C. Dubernet, P. Couvreur, Adv. Drug Deliv. Rev. 2011, 63, 3.
- S.-E. Jin, H.-E. Jin, S.-S. Hong, Biomed. Res. Int. 2014, 2014, 814208.
- V. Delplace, P. Couvreur, J. Nicolas, Polym. Chem. 2014, 5, 1529.
- M. K. Riaz, M. A. Riaz, X. Zhang, C. Lin, K. H. Wong, X. Chen, G. Zhang, A. Lu, Z. Yang, Int. J. Mol. Sci. 2018, 19, 195.
- C. D. Spicer, C. Jumeaux, B. Gupta, M. M. Stevens, Chem. Soc. Rev. 2018, 47, 3574.
- H. Sun, Y. Dong, J. Feijen, Z. Zhong, J. Control. Release 2018, 290, 11.
- R. Hynes, Cell 1987, 48, 549.
- M. A. Schwartz, M. D. Schaller, M. H. Ginsberg, Annu. Rev. Cell Dev. Biol. 1995, 11, 549.
- J. S. Desgrosellier, D. A. Cheresh, Nat. Rev. Cancer 2010, 10, 9.
- C. Kumar, Curr. Drug Targets 2003, 4, 123.
- M. D. Pierschbacher, E. Ruoslahti, Nature 1984, 309, 30.
- E. F. Plow, T. A. Haas, L. Zhang, J. Loftus, J. W. Smith, J. Biol. Chem. 2000, 275, 21785.
- C. Ryppa, H. Mann-Steinberg, I. Fichtner, H. Weber, R. Satchi-Fainaro, M. L. Biniossek, F. Kratz, Bioconjug. Chem. 2008, 19, 1414.
- Y. Gilad, E. Noy, H. Senderowitz, A. Albeck, M. A. Firer, G. Gellerman, Biopolymers 2016, 106, 160.
- K. Chen, X. Chen, Theranostics 2011, 1, 189.
- L. Sancey, E. Garanger, S. Foillard, G. Schoehn, A. Hurbin, C. Albiges-Rizo, D. Boturyn, C. Souchier, A. Grichine, P. Dumy, J. L. Coll, Mol. Ther. 2009, 17, 837.
- K. N. Sugahara, T. Teesalu, P. P. Karmali, V. R. Kotamraju, L. Agemy, O. M. Girard, D. Hanahan, R. F. Mattrey, E. Ruoslahti, Cancer Cell 2009, 16, 510.
- M. J. Wieduwilt, M. M. Moasser, Cell. Mol. Life Sci. 2008, 65, 1566.
- Y. Yarden, G. Pines, Nat. Rev. Cancer 2012, 12, 553.
- P. Seshacharyulu, M. P. Ponnusamy, D. Haridas, M. Jain, A. K. Ganti, S. K. Batra, Expert Opin. Ther. Targets 2012, 16, 15.
- Z. Li, R. Zhao, X. Wu, Y. Sun, M. Yao, J. Li, Y. Xu, J. Gu, FASEB J. 2005, 19, 1978.
- S. Ai, T. Jia, W. Ai, J. Duan, Y. Liu, J. Chen, X. Liu, F. Yang, Y. Tian, Z. Huang, Br. J. Pharmacol. 2013, 168, 1719.
- Y. C. Patel, Front. Neuroendocrinol. 1999, 20, 157.
- G. Olias, C. Viollet, H. Kusserow, J. Epelbaum, W. Meyerhof, J. Neurochem. 2004, 89, 1057.
- M. Volante, R. Rosas, E. Allìa, R. Granata, A. Baragli, G. Muccioli, M. Papotti, Mol. Cell. Endocrinol. 2008, 286, 219.
- L.-C. Sun, D. H. Coy, Curr. Drug Deliv. 2011, 8, 2.
- O. Keskin, S. Yalcin, OncoTargets Ther. 2013, 6, 471.
- G. S. Harrison, M. E. Wierman, T. M. Nett, L. M. Glode, Endocr. Relat. Cancer 2004, 11, 725.
- R. P. Millar, Anim. Reprod. Sci. 2005, 88, 5.
- P. Limonta, M. Montagnani Marelli, S. Mai, M. Motta, L. Martini, R. M. Moretti, Endocr. Rev. 2012, 33, 784.
- C. Gründker, G. Emons, Front. Endocrinol. 2017, 8, 187.
- A. V. Schally, A. Nagy, Eur. J. Endocrinol. 1999, 141, 1.
- M. Kovács, B. Vincze, J. E. Horváth, J. Seprodi, Peptides 2007, 28, 821.
- I. Ramos-Álvarez, P. Moreno, S. A. Mantey, T. Nakamura, B. Nuche-Berenguer, T. W. Moody, D. H. Coy, R. T. Jensen, Peptides 2015, 72, 128.
- V. Erspamer, G. F. Erspamer, M. Inselvini, J. Pharm. Pharmacol. 1970, 22, 875.
- R. T. Jensen, J. F. Battey, E. R. Spindel, R. V. Benya, Pharmacol. Rev. 2008, 60, 1.
- D. B. Cornelio, R. Roesler, G. Schwartsmann, Ann. Oncol. 2007, 18, 1457.
- T. K. Pradhan, T. Katsuno, J. E. Taylor, S. H. Kim, R. R. Ryan, S. A. Mantey, P. J. Donohue, H. C. Weber, E. Sainz, J. F. Battey, D. H. Coy, R. T. Jensen, Eur. J. Pharmacol. 1998, 343, 275.
- T. W. Moody, S. A. Mantey, J. A. Fuselier, D. H. Coy, R. T. Jensen, Peptides 2007, 28, 1883.
- B. Tang, X. Yong, R. Xie, Q.-W. Li, S.-M. Yang, Int. J. Oncol. 2014, 44, 1023.
- Z. Wu, D. Martinez-Fong, J. Trédaniel, P. Forgez, Front. Endocrinol. 2012, 3, 184.
- K. P. Kokko, M. K. Hadden, K. S. Orwig, J. Mazella, T. A. Dix, J. Med. Chem. 2003, 46, 4141.
- L. Gaviglio, A. Gross, N. Metzler-Nolte, M. Ravera, Metallomics 2012, 4, 260.
- J. C. Reubi, Curr. Top. Med. Chem. 2007, 7, 1239.
- J. P. Smith, L. K. Fonkoua, T. W. Moody, Int. J. Biol. Sci. 2016, 12, 283.
- P. Laverman, L. Joosten, A. Eek, S. Roosenburg, P. K. Peitl, T. Maina, H. Mäcke, L. Aloj, E. von Guggenberg, J. K. Sosabowski, M. de Jong, J. C. Reubi, W. J. G. Oyen, O. C. Boerman, Eur. J. Nucl. Med. Mol. Imaging 2011, 38, 1410.
- S. F. A. Rizvi, S. A. R. Naqvi, S. Roohi, T. A. Sherazi, R. Rasheed, Mol. Biol. Rep. 2018, 45, 1759.
- S. Froidevaux, A. N. Eberle, J. Recept. Signal Transduct. Res. 2002, 22, 111.
- H. Helmbach, E. Rossmann, M. A. Kern, D. Schadendorf, Int. J. Cancer 2001, 93, 617.
- S. Froidevaux, M. Calame-Christe, H. Tanner, A. N. Eberle, J. Nucl. Med. 2005, 46, 887.
- D. M. Rosenbaum, S. G. F. Rasmussen, B. K. Kobilka, Nature 2009, 459, 356.
- M. J. M. Niesen, S. Bhattacharya, N. Vaidehi, J. Am. Chem. Soc. 2011, 133, 13197.
- M. Freissmuth, P. J. Casey, A. G. Gilman, FASEB J. 1989, 3, 2125.
- C. A. C. Moore, S. K. Milano, J. L. Benovic, Annu. Rev. Physiol. 2007, 69, 451.
- A. Nieto Gutierrez, P. H. McDonald, Cell. Signal. 2017, 41, 65.
- A. D. Howard, S. D. Feighner, D. F. Cully, J. P. Arena, P. A. Liberator, C. I. Rosenblum, M. Hamelin, D. L. Hreniuk, O. C. Palyha, J. Anderson, P. S. Paress, C. Diaz, M. Chou, K. K. Liu, K. K. McKee, S. S. Pong, L. Y. Chaung, A. Elbrecht, M. Dashkevicz, R. Heavens, M. Rigby, D. J. S. Sirinathsinghji, D. C. Dean, D. G. Melillo, A. A. Patchett, R. Nargund, P. R. Griffin, J. A. DeMartino, S. K. Gupta, J. M. Schaeffer, R. G. Smith, L. H. T. van der Ploeg, Science 1996, 273, 974.
- M. Kojima, K. Kangawa, Physiol. Rev. 2005, 85, 495.
- B. Ueberberg, N. Unger, W. Saeger, K. Mann, S. Petersenn, Horm. Metab. Res. 2009, 41, 814.
- R. G. Smith, L. H. van der Ploeg, A. D. Howard, S. D. Feighner, K. Cheng, G. J. Hickey, M. J. Wyvratt, M. H. Fisher, R. P. Nargund, A. A. Patchett, Endocr. Rev. 1997, 18, 621.
- M. Kojima, H. Hosoda, Y. Date, M. Nakazato, H. Matsuo, K. Kangawa, Nature 1999, 402, 656.
- T. D. Müller, R. Nogueiras, M. L. Andermann, Z. B. Andrews, S. D. Anker, J. Argente, R. L. Batterham, S. C. Benoit, C. Y. Bowers, F. Broglio, F. F. Casanueva, D. D'Alessio, I. Depoortere, A. Geliebter, E. Ghigo, P. A. Cole, M. Cowley, D. E. Cummings, A. Dagher, S. Diano, S. L. Dickson, C. Diéguez, R. Granata, H. J. Grill, K. Grove, K. M. Habegger, K. Heppner, M. L. Heiman, L. Holsen, B. Holst, A. Inui, J. O. Jansson, H. Kirchner, M. Korbonits, B. Laferrère, C. W. LeRoux, M. Lopez, S. Morin, M. Nakazato, R. Nass, D. Perez-Tilve, P. T. Pfluger, T. W. Schwartz, R. J. Seeley, M. Sleeman, Y. Sun, L. Sussel, J. Tong, M. O. Thorner, A. J. van der Lely, L. H. T. van der Ploeg, J. M. Zigman, M. Kojima, K. Kangawa, R. G. Smith, T. Horvath, M. H. Tschöp, Mol. Metab. 2015, 4, 437.
- A. M. Wren, L. J. Seal, M. A. Cohen, A. E. Brynes, G. S. Frost, K. G. Murphy, W. S. Dhillo, M. A. Ghatei, S. R. Bloom, J. Clin. Endocrinol. Metab. 2001, 86, 5992.
- Y. Sun, P. Wang, H. Zheng, R. G. Smith, Proc. Natl. Acad. Sci. U. S. A. 2004, 101, 4679.
- K. M. Heppner, J. Tong, Eur. J. Endocrinol. 2014, 171, R21.
- H. Hosoda, M. Kojima, K. Kangawa, J. Pharmacol. Sci. 2006, 100, 398.
- S. L. Dickson, E. Egecioglu, S. Landgren, K. P. Skibicka, J. A. Engel, E. Jerlhag, Mol. Cell. Endocrinol. 2011, 340, 80.
- B. Holst, T. W. Schwartz, Trends Pharmacol. Sci. 2004, 25, 113.
- J. Pantel, M. Legendre, S. Cabrol, L. Hilal, Y. Hajaji, S. Morisset, S. Nivot, M.-P. Vie-Luton, D. Grouselle, M. de Kerdanet, A. Kadiri, J. Epelbaum, Y. le Bouc, S. Amselem, J. Clin. Invest. 2006, 116, 760.
- Y. Yin, Y. Li, W. Zhang, Int. J. Mol. Sci. 2014, 15, 4837.
- N. Mizuno, H. Itoh, Neurosignals 2009, 17, 42.
- J. P. Camiña, M. C. Carreira, S. El Messari, C. Llorens-Cortes, R. G. Smith, F. F. Casanueva, Endocrinology 2004, 145, 930.
- N. D. Holliday, B. Holst, E. A. Rodionova, T. W. Schwartz, H. M. Cox, Mol. Endocrinol. 2007, 21, 3100.
- D. Nikolopoulos, S. Theocharis, G. Kouraklis, Regul. Pept. 2010, 163, 7.
- L. Chopin, C. Walpole, I. Seim, P. Cunningham, R. Murray, E. Whiteside, P. Josh, A. Herington, Mol. Cell. Endocrinol. 2011, 340, 65.
- T.-C. Lin, M. Hsiao, Biochim. Biophys. Acta 2017, 1868, 51.
- P. A. Carpino, Expert Opin. Ther. Pat. 2002, 12, 1599.
- S. Els, A. G. Beck-Sickinger, C. Chollet, Methods Enzymol. 2010, 485, 103.
- K. O. Cameron, S. K. Bhattacharya, A. K. Loomis, J. Med. Chem. 2014, 57, 8671.
- R. P. Nargund, A. A. Patchett, M. A. Bach, M. G. Murphy, R. G. Smith, J. Med. Chem. 1998, 41, 3103.
- M. Vodnik, B. Strukelj, M. Lunder, Horm. Metab. Res. 2016, 48, 1.
- B. Holst, A. Cygankiewicz, T. H. Jensen, M. Ankersen, T. W. Schwartz, Mol. Endocrinol. 2003, 17, 2201.
- B. Holst, M. Lang, E. Brandt, A. Bach, A. Howard, T. M. Frimurer, A. Beck-Sickinger, T. W. Schwartz, Mol. Pharmacol. 2006, 70, 936.
- B. Holst, J. Mokrosinski, M. Lang, E. Brandt, R. Nygaard, T. M. Frimurer, A. G. Beck-Sickinger, T. W. Schwartz, J. Biol. Chem. 2007, 282, 15799.
- B. Sivertsen, M. Lang, T. M. Frimurer, N. D. Holliday, A. Bach, S. Els, M. S. Engelstoft, P. S. Petersen, A. N. Madsen, T. W. Schwartz, A. G. Beck-Sickinger, B. Holst, J. Biol. Chem. 2011, 286, 20845.
- S. Els, E. Schild, P. S. Petersen, T.-M. Kilian, J. Mokrosinski, T. M. Frimurer, C. Chollet, T. W. Schwartz, B. Holst, A. G. Beck-Sickinger, J. Med. Chem. 2012, 55, 7437.
- C. Wahlestedt, D. J. Reis, Annu. Rev. Pharmacol. Toxicol. 1993, 33, 309.
- M. Yi, H. Li, Z. Wu, J. Yan, Q. Liu, C. Ou, M. Chen, Cell. Physiol. Biochem. 2018, 45, 88.
- 104A. D. Nguyen, N. F. Mitchell, S. Lin, L. Macia, E. Yulyaningsih, P. A. Baldock, R. F. Enriquez, L. Zhang, Y.-C. Shi, S. Zolotukhin, H. Herzog, A. Sainsbury, PLoS One 2012, 7, e40191.
- D. Verma, R. O. Tasan, H. Herzog, G. Sperk, Br. J. Pharmacol. 2012, 166, 1461.
- G. J. Hodges, D. N. Jackson, L. Mattar, J. M. Johnson, J. K. Shoemaker, Y. Neuropeptide, Am. J. Physiol. 2009, 297, R546.
- M. C. Michel, A. Beck-Sickinger, H. Cox, H. N. Doods, H. Herzog, D. Larhammar, R. Quirion, T. Schwartz, T. Westfall, Pharmacol. Rev. 1998, 50, 143.
- D. Larhammar, Regul. Pept. 1996, 62, 1.
- X. Pedragosa-Badia, J. Stichel, A. G. Beck-Sickinger, Front. Endocrinol. 2013, 4, 5.
- H. Herzog, Y. J. Hort, H. J. Ball, G. Hayes, J. Shine, L. A. Selbie, Proc. Natl. Acad. Sci. U. S. A. 1992, 89, 5794.
- H. Gicquiaux, S. Lecat, M. Gaire, A. Dieterlen, Y. Mély, K. Takeda, B. Bucher, J.-L. Galzi, J. Biol. Chem. 2002, 277, 6645.
- K. Morl, A. G. Beck-Sickinger, Prog. Mol. Biol. Transl. Sci. 2015, 132, 73.
- P. Holzer, F. Reichmann, A. Farzi, Y. Neuropeptide, Neuropeptides 2012, 46, 261.
- S. A. Monks, G. Karagianis, G. J. Howlett, R. S. Norton, J. Biomol. NMR 1996, 8, 379.
- C. Cabrele, A. G. Beck-Sickinger, J. Pept. Sci. 2000, 6, 97.
- D. Zwanziger, I. Böhme, D. Lindner, A. G. Beck-Sickinger, J. Pept. Sci. 2009, 15, 856.
- R. M. Söll, M. C. Dinger, I. Lundell, D. Larhammer, A. G. Beck-Sickinger, Eur. J. Biochem. 2001, 268, 2828.
- Z. Yang, S. Han, M. Keller, A. Kaiser, B. J. Bender, M. Bosse, K. Burkert, L. M. Kögler, D. Wifling, G. Bernhardt, N. Plank, T. Littmann, P. Schmidt, C. Yi, B. Li, S. Ye, R. Zhang, B. Xu, D. Larhammar, R. C. Stevens, D. Huster, J. Meiler, Q. Zhao, A. G. Beck-Sickinger, A. Buschauer, B. Wu, Nature 2018, 556, 520.
- S. P. Brothers, C. Wahlestedt, EMBO Mol. Med. 2010, 2, 429.
- M. Korner, J. C. Reubi, Peptides 2007, 28, 419.
- M. Körner, B. Waser, J. C. Reubi, Clin. Cancer Res. 2008, 14, 5043.
- J. C. Reubi, M. Gugger, B. Waser, J.-C. Schaer, Cancer Res. 2001, 61, 4636.
- S. Hofmann, S. Maschauer, T. Kuwert, A. G. Beck-Sickinger, O. Prante, Mol. Pharm. 2015, 12, 1121.
- I. U. Khan, D. Zwanziger, I. Böhme, M. Javed, H. Naseer, S. W. Hyder, A. G. Beck-Sickinger, Angew. Chem. Int. Ed. Engl. 2010, 49, 1155.
- C. Zhang, J. Pan, K.-S. Lin, I. Dude, J. Lau, J. Zeisler, H. Merkens, S. Jenni, B. Guérin, F. Bénard, Mol. Pharm. 2016, 13, 3657.
- J. Li, Z. Shen, X. Ma, W. Ren, L. Xiang, A. Gong, T. Xia, J. Guo, A. Wu, Y. Neuropeptide, ACS Appl. Mater. Interfaces 2015, 7, 5574.
- S. Avvakumova, E. Galbiati, L. Sironi, S. A. Locarno, L. Gambini, C. Macchi, L. Pandolfi, M. Ruscica, P. Magni, M. Collini, M. Colombo, F. Corsi, G. Chirico, S. Romeo, D. Prosperi, Bioconjug. Chem. 2016, 27, 2911.
- Z. Yu, Y. Xia, J. Xing, Z. Li, J. Zhen, Y. Jin, Y. Tian, C. Liu, Z. Jiang, J. Li, A. Wu, Nanoscale 2018, 10, 17038.
- J. Li, Y. Du, Z. Jiang, Y. Tian, N. Qiu, Y. Wang, M. Z. Lqbal, M. Hu, R. Zou, L. Luo, S. Du, J. Tian, A. Wu, Nanoscale 2018, 10, 5845.
- Q. Jiao, L. Bi, Y. Ren, S. Song, Q. Wang, Y.-S. Wang, Mol. Cancer 2018, 17, 36.
- F.-L. Tukun, D. E. Olberg, P. J. Riss, I. Haraldsen, A. Kaass, J. Klaveness, Molecules 2017, 22, E2188.
- M. Srinivasarao, C. V. Galliford, P. S. Low, Nat. Rev. Drug Discov. 2015, 14, 203.
- I. R. Vlahov, H. K. R. Santhapuram, P. J. Kleindl, S. J. Howard, K. M. Stanford, C. P. Leamon, Bioorg. Med. Chem. Lett. 2006, 16, 5093.
- W. S. Graybill, R. L. Coleman, Future Oncol. 2014, 10, 541.
- A. M. Oza, I. B. Vergote, L. G. Gilbert, P. Lucy, A. Ghatage, S. Lisyankaya, S. K. Ghamande, J. A. Chambers, J. A. Arranzh, D. M. Provencheri, P. Bessettej, A. Amnonk, J. Symanowskil, R. T. Pensonm, R. W. Naumannl, R. Clarkn, Gynecol. Oncol. 2015, 137, 5.
- C. Wayua, J. Roy, K. S. Putt, P. S. Low, Mol. Pharm. 2015, 12, 2477.
- P. Slobbe, A. J. Poot, A. D. Windhorst, G. A. M. S. van Dongen, Drug Discov. Today 2012, 17, 1175.
- C. Wayua, P. S. Low, Mol. Pharm. 2014, 11, 468.
- R.-P. Moldovan, S. Els-Heindl, D. J. Worm, T. Kniess, M. Kluge, A. G. Beck-Sickinger, W. Deuther-Conrad, U. Krügel, P. Brust, Int. J. Mol. Sci. 2017, 18, 768.
- J.-Q. Hou, M. S. Kovacs, S. Dhanvantari, L. G. Luyt, J. Med. Chem. 2018, 61, 1261.
- V. M. Ahrens, K. Bellmann-Sickert, A. G. Beck-Sickinger, Future Med. Chem. 2012, 4, 1567.
- V. Mäde, S. Els-Heindl, A. G. Beck-Sickinger, Beilstein J. Org. Chem. 2014, 10, 1197.
- P. Vlieghe, V. Lisowski, J. Martinez, M. Khrestchatisky, Drug Discov. Today 2010, 15, 40.
- M. Erak, K. Bellmann-Sickert, S. Els-Heindl, A. G. Beck-Sickinger, Bioorg. Med. Chem. 2018, 26, 2759.
- L. Zhang, G. Bulaj, Curr. Med. Chem. 2012, 19, 1602.
- S. Frokjaer, D. E. Otzen, Nat. Rev. Drug Discov. 2005, 4, 298.
- I. Guryanov, A. Bondesan, D. Visentini, A. Orlandin, B. Biondi, C. Toniolo, F. Formaggio, A. Ricci, J. Zanon, W. Cabri, J. Pept. Sci. 2016, 22, 471.
- S. P. Marso, S. C. Bain, A. Consoli, F. G. Eliaschewitz, E. Jódar, L. A. Leiter, I. Lingvay, J. Rosenstock, J. Seufert, M. L. Warren, V. Woo, O. Hansen, A. G. Holst, J. Pettersson, T. Vilsbøll, SUSTAIN-6 Investigators, N. Engl. J. Med. 2016, 375, 1834.
- V. Sancho, A. Di Florio, T. W. Moody, R. T. Jensen, Curr. Drug Deliv. 2011, 8, 79.
- S. Good, M. A. Walter, B. Waser, X. Wang, J. Müller-Brand, M. P. Béhé, J.-C. Reubi, H. R. Maecke, Eur. J. Nucl. Med. Mol. Imaging 2008, 35, 1868.
- V. M. Ahrens, R. Frank, S. Boehnke, C. L. Schutz, G. Hampel, D. S. Iffland, N. H. Bings, E. Hey-Hawkins, A. G. Beck-Sickinger, ChemMedChem 2015, 10, 164.
- V. Mäde, S. Babilon, N. Jolly, L. Wanka, K. Bellmann-Sickert, L. E. Diaz Gimenez, K. Mörl, H. M. Cox, V. Gurevich, A. G. Beck-Sickinger, Angew. Chem. Int. Ed. 2014, 53, 10067.
- I. Böhme, J. Stichel, C. Walther, K. Mörl, A. G. Beck-Sickinger, Cell. Signal. 2008, 20, 1740.
- V. M. Ahrens, R. Frank, S. Stadlbauer, A. G. Beck-Sickinger, E. Hey-Hawkins, J. Med. Chem. 2011, 54, 2368.
- F. Kratz, I. A. Müller, C. Ryppa, A. Warnecke, ChemMedChem 2008, 3, 20.
- M. Chang, F. Zhang, T. Wei, T. Zuo, Y. Guan, G. Lin, W. Shao, J. Drug Target. 2016, 24, 475.
- S. Ohkuma, B. Poole, Proc. Natl. Acad. Sci. U. S. A. 1978, 75, 3327.
- G. Saito, J. A. Swanson, K.-D. Lee, Adv. Drug Deliv. Rev. 2003, 55, 199.
- S. W. Cha, H. K. Gu, K. P. Lee, M. H. Lee, S. S. Han, T. C. Jeong, Toxicol. Lett. 2000, 115, 173.
- L. H. Patterson, S. R. McKeown, T. Robson, R. Gallagher, S. M. Raleigh, S. Orr, Anticancer Drug Des. 1999, 14, 473.
- A. Ciechanover, Angew. Chem. Int. Ed. 2005, 44, 5944.
- A. Szlachcic, M. Zakrzewska, M. Lobocki, P. Jakimowicz, J. Otlewski, Drug Des. Dev. Ther 2016, 10, 2547.
- S. A. R. Naqvi, T. Matzow, C. Finucane, S. A. Nagra, M. M. Ishfaq, S. J. Mather, J. Sosabowski, Cancer Biother. Radiopharm. 2010, 25, 89.
- C. S. Gondi, J. S. Rao, Expert Opin. Ther. Targets 2013, 17, 281.
- I. Tranoy-Opalinski, A. Fernandes, M. Thomas, J.-P. Gesson, S. Papot, Anticancer Agents Med Chem. 2008, 8, 618.
- G. Housman, S. Byler, S. Heerboth, K. Lapinska, M. Longacre, N. Snyder, S. Sarkar, Cancer 2014, 6, 1769.
- V. Malhotra, M. C. Perry, Cancer Biol. Ther. 2003, 2, 1.
- A. G. Weidmann, A. C. Komor, J. K. Barton, Comments Inorg. Chem. 2014, 34, 114.
- M. E. Wall, M. C. Wani, J. Ethnopharmacol. 1996, 51, 239.
- G. Minotti, P. Menna, E. Salvatorelli, G. Cairo, L. Gianni, Pharmacol. Rev. 2004, 56, 185.
- C. M. Galmarini, J. R. Mackey, C. Dumontet, Lancet Oncol. 2002, 3, 415.
- L. Genestier, R. Paillot, L. Quemeneur, K. Izeradjene, J.-P. Revillard, Immunopharmacology 2000, 47, 247.
- H. Xiao, P. Verdier-Pinard, N. Fernandez-Fuentes, B. Burd, R. Angeletti, A. Fiser, S. B. Horwitz, G. A. Orr, Proc. Natl. Acad. Sci. U. S. A. 2006, 103, 10166.
- X. J. Zhou, R. Rahmani, Drugs 1992, 44(Suppl 4), 1 discussion 66–9.
- C. M. Huang, Y. T. Wu, S. T. Chen, Chem. Biol. 2000, 7, 453.
- H. Shen, D. Hu, J. Du, X. Wang, Y. Liu, Y. Wang, J. M. Wei, D. Ma, P. Wang, L. Li, Eur. J. Pharmacol. 2008, 601, 23.
- A. Nagy, A. V. Schally, G. Halmos, P. Armatis, R.-Z. Cai, V. Csernus, M. Kovács, M. Koppán, K. Szepesházi, Z. Kahán, Proc. Natl. Acad. Sci. U. S. A. 1998, 95, 1794.
- J. B. Engel, A. V. Schally, G. Halmos, B. Baker, A. Nagy, G. Keller, Cancer 2005, 104, 1312.
- S. Seitz, A. V. Schally, A. Treszl, A. Papadia, F. Rick, L. Szalontay, K. Szepeshazi, O. Ortmann, G. Halmos, F. Hohla, S. Buchholz, Anticancer Drugs 2009, 20, 553.
- B. Redko, E. Ragozin, B. Andreii, T. Helena, A. Amnon, S. Z. Talia, O.-H. Mor, K. Genady, G. Gary, Biopolymers 2015, 104, 743.
- E. Ragozin, A. Hesin, A. Bazylevich, H. Tuchinsky, A. Bovina, T. Shekhter Zahavi, M. Oron-Herman, G. Kostenich, M. A. Firer, T. Rubinek, I. Wolf, G. Luboshits, M. Y. Sherman, G. Gellerman, Bioorg. Med. Chem. 2018, 26, 3825.
- Y. Gilad, E. Noy, H. Senderowitz, A. Albeck, M. A. Firer, G. Gellerman, Bioorg. Med. Chem. 2016, 24, 294.
- B. Redko, H. Tuchinsky, T. Segal, D. Tobi, G. Luboshits, O. Ashur-Fabian, A. Pinhasov, G. Gerlitz, G. Gellerman, Oncotarget 2017, 8, 757.
- T. W. Moody, L.-C. Sun, S. A. Mantey, T. Pradhan, L. V. Mackey, N. Gonzales, J. A. Fuselier, D. H. Coy, R. T. Jensen, J. Pharmacol. Exp. Ther. 2006, 318, 1265.
- M. Langer, F. Kratz, B. Rothen-Rutishauser, H. Wunderli-Allenspach, A. G. Beck-Sickinger, J. Med. Chem. 2001, 44, 1341.
- V. M. Ahrens, K. B. Kostelnik, R. Rennert, D. Böhme, S. Kalkhof, D. Kosel, L. Weber, M. von Bergen, A. G. Beck-Sickinger, J. Control. Release 2015, 209, 170.
- D. Böhme, A. G. Beck-Sickinger, ChemMedChem 2015, 10, 804.
- D. Böhme, J. Krieghoff, A. G. Beck-Sickinger, J. Med. Chem. 2016, 59, 3409.
- R. Hegedüs, M. Manea, E. Orbán, I. Szabó, E. Kiss, E. Sipos, G. Halmos, G. Mező, Eur. J. Med. Chem. 2012, 56, 155.
- A. Nagy, A. V. Schally, P. Armatis, K. Szepeshazi, G. Halmos, M. Kovacs, M. Zarandi, K. Groot, M. Miyazaki, A. Jungwirth, J. Horvath, Proc. Natl. Acad. Sci. U. S. A. 1996, 93, 7269.
- A. V. Schally, J. B. Engel, G. Emons, N. L. Block, J. Pinski, Curr. Drug Deliv. 2011, 8, 11.
- S. S. Yu, K. Athreya, S. V. Liu, A. V. Schally, D. Tsao-Wei, S. Groshen, D. I. Quinn, T. B. Dorff, S. Xiong, J. Engel, J. Pinski, Clin. Genitourin. Cancer 2017, 15, 742.
- G. Emons, G. Gorchev, P. Harter, P. Wimberger, A. Stähle, L. Hanker, F. Hilpert, M. W. Beckmann, P. Dall, C. Gründker, H. Sindermann, J. Sehouli, Int. J. Gynecol. Cancer 2014, 24, 260.
- (Identifier: NCT01767155). Accessed October 4, 2018.
- A. Régina, M. Demeule, C. Ché, I. Lavallée, J. Poirier, R. Gabathuler, R. Béliveau, J.-P. Castaigne, Br. J. Pharmacol. 2008, 155, 185.
- F. C. Thomas, K. Taskar, V. Rudraraju, S. Goda, H. R. Thorsheim, J. A. Gaasch, R. K. Mittapalli, D. Palmieri, P. S. Steeg, P. R. Lockman, Q. R. Smith, Pharm. Res. 2009, 26, 2486.
- J. Drappatz, A. Brenner, E. T. Wong, A. Eichler, D. Schiff, M. D. Groves, T. Mikkelsen, S. Rosenfeld, J. Sarantopoulos, C. A. Meyers, R. M. Fielding, K. Elian, X. Wang, B. Lawrence, M. Shing, S. Kelsey, J. P. Castaigne, P. Y. Wen, Clin. Cancer Res. 2013, 19, 1567.
- (Identifier: NCT01967810 and NCT02048059). Accessed October 4, 2018.
- P. Kumthekar, S.-C. Tang, A. J. Brenner, S. Kesari, D. E. Piccioni, C. K. Anders, J. A. Carrillo, P. Chalasani, P. Kabos, S. L. Puhalla, K. H. R. Tkaczuk, A. Garcia, M. S. Ahluwalia, J. S. Wefel, N. Lakhani, N. K. Ibrahim, Clin. Cancer Res. 2020. (Identifier: NCT03613181). Accessed April 20, 2020.
- M. Schottelius, H.-J. Wester, Methods 2009, 48, 161.
- X. Sun, Y. Li, T. Liu, Z. Li, X. Zhang, X. Chen, Adv. Drug Deliv. Rev. 2017, 110-111, 38.
- M. Ginj, H. Zhang, B. Waser, R. Cescato, D. Wild, X. Wang, J. Erchegyi, J. Rivier, H. R. Mäcke, J. C. Reubi, Proc. Natl. Acad. Sci. U. S. A. 2006, 103, 16436.
- M. Fani, P. K. Peitl, I. Velikyan, Pharmaceuticals 2017, 10, 30.
- D. Wild, M. Fani, R. Fischer, L. Del Pozzo, F. Kaul, S. Krebs, J. E. F. Rivier, J. C. Reubi, H. R. Maecke, W. A. Weber, J. Nucl. Med. 2014, 55, 1248.
- S. Bhattacharyya, M. Dixit, Dalton Trans. 2011, 40, 6112.
- T. C. Karagiannis, Hell. J. Nucl. Med. 2007, 10, 82.
- J. A. O'Donoghue, M. Bardiès, T. E. Wheldon, J. Nucl. Med. 1995, 36, 1902.
- V. Goffredo, A. Paradiso, G. Ranieri, C. D. Gadaleta, Crit. Rev. Oncol. Hematol. 2011, 80, 393.
- B. L. R. Kam, J. J. M. Teunissen, E. P. Krenning, W. W. de Herder, S. Khan, E. I. van Vliet, D. J. Kwekkeboom, Eur. J. Nucl. Med. Mol. Imaging 2012, 39(Suppl 1), S103.
- E. Hindié, P. Zanotti-Fregonara, M. A. Quinto, C. Morgat, C. Champion, J. Nucl. Med. 2016, 57, 759.
- R. B. Michel, P. M. Andrews, A. V. Rosario, D. M. Goldenberg, M. J. Mattes, Nucl. Med. Biol. 2005, 32, 269.
- R. Ochakovskaya, L. Osorio, D. M. Goldenberg, M. J. Mattes, Clin. Cancer Res. 2001, 7, 1505.
- S. Lehenberger, C. Barkhausen, S. Cohrs, E. Fischer, J. Grünberg, A. Hohn, U. Köster, R. Schibli, A. Türler, K. Zhernosekov, Nucl. Med. Biol. 2011, 38, 917.
- J. Grünberg, D. Lindenblatt, H. Dorrer, S. Cohrs, K. Zhernosekov, U. Köster, A. Türler, E. Fischer, R. Schibli, Eur. J. Nucl. Med. Mol. Imaging 2014, 41, 1907.
- C. Müller, J. Reber, S. Haller, H. Dorrer, P. Bernhardt, K. Zhernosekov, A. Türler, R. Schibli, Eur. J. Nucl. Med. Mol. Imaging 2014, 41, 476.
- A. I. Kassis, Int. J. Radiat. Biol. 2004, 80, 789.
- E. Dadachova, Semin. Nucl. Med. 2010, 40, 204.
- B. L. Faintuch, N. P. S. Pereira, S. Faintuch, E. Muramoto, C. P. G. Silva, Radiochim. Acta 2003, 91, 4594.
- S. Liu, Adv. Drug Deliv. Rev. 2008, 60, 1347.
- M. Jamous, U. Haberkorn, W. Mier, Molecules 2013, 18, 3379.
- S. Liu, D. S. Edwards, Bioconjug. Chem. 2001, 12, 7.
- L. M. de León-Rodríguez, Z. Kovacs, Bioconjug. Chem. 2008, 19, 391.
- D. J. Kwekkeboom, B. L. Kam, M. van Essen, J. J. M. Teunissen, C. H. J. van Eijck, R. Valkema, M. de Jong, W. W. de Herder, E. P. Krenning, Endocr. Relat. Cancer 2010, 17, R53.
- R. Valkema, M. de Jong, W. H. Bakker, W. A. P. Breeman, P. P. M. Kooij, P. J. Lugtenburg, F. H. de Jong, A. Christiansen, B. L. R. Kam, W. W. de Herder, M. Stridsberg, J. Lindemans, G. Ensing, E. P. Krenning, Semin. Nucl. Med. 2002, 32, 110.
- M. de Jong, W. H. Bakker, W. A. Breeman, B. F. Bernard, L. J. Hofland, T. J. Visser, A. Srinivasan, M. Schmidt, M. Béhé, H. R. Mäcke, E. P. Krenning, Int. J. Cancer 1998, 75, 4
- C. Dong, Z. Liu, F. Wang, Curr. Med. Chem. 2013, 21, 139.
- R. Valkema, S. Pauwels, L. K. Kvols, R. Barone, F. Jamar, W. H. Bakker, D. J. Kwekkeboom, H. Bouterfa, E. P. Krenning, Semin. Nucl. Med. 2006, 36, 147.
- J. C. Reubi, J. C. Schär, B. Waser, S. Wenger, A. Heppeler, J. S. Schmitt, H. R. Mäcke, Eur. J. Nucl. Med. 2000, 27, 273.
- J. B. Cwikla, A. Sankowski, N. Seklecka, J. R. Buscombe, A. Nasierowska-Guttmejer, K. G. Jeziorski, R. Mikolajczak, D. Pawlak, K. Stepien, J. Walecki, Ann. Oncol. 2010, 21, 787.
- N. Hirmas, R. Jadaan, A. Al-Ibraheem, Nucl. Med. Mol. Imaging 2018, 52, 190.
- 232J. Strosberg, G. El-Haddad, E. Wolin, A. Hendifar, J. Yao, B. Chasen, E. Mittra, P. L. Kunz, M. H. Kulke, H. Jacene, D. Bushnell, T. M. O'Dorisio, R. P. Baum, H. R. Kulkarni, M. Caplin, R. Lebtahi, T. Hobday, E. Delpassand, E. Van Cutsem, A. Benson, R. Srirajaskanthan, M. Pavel, J. Mora, J. Berlin, E. Grande, N. Reed, E. Seregni, K. Öberg, M. Lopera Sierra, P. Santoro, T. Thevenet, J. L. Erion, P. Ruszniewski, D. Kwekkeboom, E. Krenning, NETTER-1 Trial Investigators, N. Engl. J. Med. 2017, 376, 125.
- M. L. Janssen, W. J. Oyen, I. Dijkgraaf, L. F. Massuger, C. Frielink, D. S. Edwards, M. Rajopadhye, H. Boonstra, F. H. Corstens, O. C. Boerman, Cancer Res. 2002, 62, 6146.
- M. Janssen, C. Frielink, I. Dijkgraaf, W. Oyen, D. S. Edwards, S. Liu, M. Rajopadhye, L. Massuger, F. Corstens, O. Boerman, Cancer Biother. Radiopharm. 2004, 19, 399.
- Z. Liu, J. Shi, B. Jia, Z. Yu, Y. Liu, H. Zhao, F. Li, J. Tian, X. Chen, S. Liu, F. Wang, Mol. Pharm. 2011, 8, 591.
- C. V. Johnson, T. Shelton, C. J. Smith, L. Ma, M. C. Perry, W. A. Volkert, T. J. Hoffman, Cancer Biother. Radiopharm. 2006, 21, 155.
- L. E. Lantry, E. Cappelletti, M. E. Maddalena, J. S. Fox, W. Feng, J. Chen, R. Thomas, S. M. Eaton, N. J. Bogdan, T. Arunachalam, J. C. Reubi, N. Raju, E. C. Metcalfe, L. Lattuada, K. E. Linder, R. E. Swenson, M. F. Tweedle, A. D. Nunn, J. Nucl. Med. 2006, 47, 1144.
- Y. Miao, N. K. Owen, D. R. Fisher, T. J. Hoffman, T. P. Quinn, J. Nucl. Med. 2005, 46, 121.
- D. Zwanziger, I. U. Khan, I. Neundorf, S. Sieger, L. Lehmann, M. Friebe, L. Dinkelborg, A. G. Beck-Sickinger, Bioconjug. Chem. 2008, 19, 1430.
- M. F. Hawthorne, Angew. Chem. Int. Ed. Engl. 1993, 32, 950.
- A. H. Soloway, W. Tjarks, B. A. Barnum, F.-G. Rong, R. F. Barth, I. M. Codogni, J. G. Wilson, Chem. Rev. 1998, 98, 1515.
- R. F. Barth, J. A. Coderre, M. G. H. Vicente, T. E. Blue, Clin. Cancer Res. 2005, 11, 3987.
- R. F. Barth, Z. Zhang, T. Liu, Cancer Commun. 2018, 38, 36.
- R. F. Barth, M. G. H. Vicente, O. K. Harling, W. S. Kiger III., K. J. Riley, P. J. Binns, F. M. Wagner, M. Suzuki, T. Aihara, I. Kato, S. Kawabata, Radiat. Oncol. 2012, 7, 146.
- T. Hartman, J. Carlsson, Radiother. Oncol. 1994, 31, 61.
- H. R. Snyder, A. J. Reedy, W. J. Lennarz, J. Am. Chem. Soc. 1958, 80, 835.
- A. H. Soloway, H. Hatanaka, M. A. Davis, J. Med. Chem. 1967, 10, 714.
- Y. Mori, A. Suzuki, K. Yoshino, H. Kakihana, Pigment Cell Res. 1989, 2, 273.
- A. Wittig, W. A. Sauerwein, J. A. Coderre, Radiat. Res. 2000, 153, 173.
- S. Kawabata, S.-I. Miyatake, N. Nonoguchi, R. Hiramatsu, K. Iida, S. Miyata, K. Yokoyama, A. Doi, Y. Kuroda, T. Kuroiwa, H. Michiue, H. Kumada, M. Kirihata, Y. Imahori, A. Maruhashi, Y. Sakurai, M. Suzuki, S. I. Masunaga, K. Ono, Appl. Radiat. Isot. 2009, 67, S15.
- M. J. Luderer, P. de la Puente, A. K. Azab, Pharm. Res. 2015, 32, 2824.
- R. F. Barth, P. Mi, W. Yang, Cancer Commun. 2018, 38, 35.
- J. Capala, R. F. Barth, M. Bendayan, M. Lauzon, D. M. Adams, A. H. Soloway, R. A. Fenstermaker, J. Carlsson, Bioconjug. Chem. 1996, 7, 7.
- W. Yang, R. F. Barth, G. Wu, T. Huo, W. Tjarks, M. Ciesielski, R. A. Fenstermaker, B. D. Ross, C. J. Wikstrand, K. J. Riley, P. J. Binns, J. Neurooncol. 2009, 95, 355.
- G. Wu, R. F. Barth, W. Yang, M. Chatterjee, W. Tjarks, M. J. Ciesielski, R. A. Fenstermaker, Bioconjug. Chem. 2004, 15, 185.
- G. Wu, W. Yang, R. F. Barth, S. Kawabata, M. Swindall, A. K. Bandyopadhyaya, W. Tjarks, B. Khorsandi, T. E. Blue, A. K. Ferketich, M. Yang, G. A. Christoforidis, T. J. Sferra, P. J. Binns, K. J. Riley, M. J. Ciesielski, R. A. Fenstermaker, Clin. Cancer Res. 2007, 13, 1260.
- W. Yang, R. F. Barth, G. Wu, S. Kawabata, T. J. Sferra, A. K. Bandyopadhyaya, W. Tjarks, A. K. Ferketich, M. L. Moeschberger, P. J. Binns, K. J. Riley, J. A. Coderre, M. J. Ciesielski, R. A. Fenstermaker, C. J. Wikstrand, Clin. Cancer Res. 2006, 12, 3792.
- W. Yang, G. Wu, R. F. Barth, M. R. Swindall, A. K. Bandyopadhyaya, W. Tjarks, K. Tordoff, M. Moeschberger, T. J. Sferra, P. J. Binns, K. J. Riley, M. J. Ciesielski, R. A. Fenstermaker, C. J. Wikstrand, Clin. Cancer Res. 2008, 14, 883.
- W. Yang, R. F. Barth, G. Wu, W. Tjarks, P. Binns, K. Riley, Appl. Radiat. Isot. 2009, 67, S328.
- M. Scholz, E. Hey-Hawkins, Chem. Rev. 2011, 111, 7035.
- J. F. Valliant, K. J. Guenther, A. S. King, P. Morel, P. Schaffer, O. O. Sogbein, K. A. Stephenson, Coord. Chem. Rev. 2002, 232, 173.
- S. Kimura, S.-i. Masunaga, T. Harada, Y. Kawamura, S. Ueda, K. Okuda, H. Nagasawa, Bioorg. Med. Chem. 2011, 19, 1721.
- S.-I. Masunaga, S. Kimura, T. Harada, K. Okuda, Y. Sakurai, H. Tanaka, M. Suzuki, N. Kondo, A. Maruhashi, H. Nagasawa, K. Ono, World J. Oncol. 2012, 3, 103.
- E. Schirrmacher, R. Schirrmacher, C. Beck, W. Mier, N. Trautman, F. Rösch, Tetrahedron Lett. 2003, 44, 9143.
- W. Mier, D. Gabel, U. Haberkorn, M. Eisenhut, Z. Anorg. Allg. Chem. 2004, 630, 1258.
- T. Betzel, T. Hess, B. Waser, J.-C. Reubi, F. Roesch, Bioconjug. Chem. 2008, 19, 1796.
- D. J. Worm, S. Els-Heindl, M. Kellert, R. Kuhnert, S. Saretz, J. Koebberling, B. Riedl, E. Hey-Hawkins, A. G. Beck-Sickinger, J. Pept. Sci. 2018, 24, e3119.
- R. Frank, M. Ahrens, S. Boehnke, A. G. Beck-Sickinger, E. Hey-Hawkins, ChemBioChem 2016, 17, 308.
- M. Kellert, D. J. Worm, P. Hoppenz, M. B. Sárosi, P. Lönnecke, B. Riedl, J. Koebberling, A. G. Beck-Sickinger, E. Hey-Hawkins, Dalton Trans. 2019, 48, 10834.
- D. J. Worm, P. Hoppenz, S. Els-Heindl, M. Kellert, R. Kuhnert, S. Saretz, J. Köbberling, B. Riedl, E. Hey-Hawkins, A. G. Beck-Sickinger, J. Med. Chem. 2019, 63, 2358.
- H. Michiue, Y. Sakurai, N. Kondo, M. Kitamatsu, F. Bin, K. Nakajima, Y. Hirota, S. Kawabata, T.-i. Nishiki, I. Ohmori, K. Tomizawa, S. I. Miyatake, K. Ono, H. Matsui, Biomaterials 2014, 35, 3396.
- Y. Iguchi, H. Michiue, M. Kitamatsu, Y. Hayashi, F. Takenaka, T.-I. Nishiki, H. Matsui, Biomaterials 2015, 56, 10.
