Регуляторные пептиды: их продукция, транспорт и эффекты

Содержание

1.1. Пептидная регуляция: ключевые вопросы
В организме человека есть три источника белков:
а) пища;
б) кишечные бактерии;
в) клетки самого организма.
Любая белковая молекула, независимо от ее источника, в итоге расщепляется с помощью ферментов на ряд коротких пептидных фрагментов. Почти все фрагменты являются лишь промежуточными звеньями на пути к дальнейшему расщеплению. Лишь небольшая часть таких фрагментов участвует в регуляторных процессах, взаимодействуя с клетками-мишенями сквозь рецепторы или каким-либо иным способом.
Совокупность вопросов, связанных с пептидной регуляцией, можно свести к четырем ключевым вопросам:
- Каковы механизмы синтеза регуляторных пептидов (рибосомальные и/или нерибосомальные)?
- Какие клетки, ткани и органы продуцируют регуляторные пептиды?
- Как регуляторные пептиды проходят сквозь барьеры (кишечную стенку, клеточную и ядерную мембраны)?
- Каковы механизмы взаимодействия регуляторных пептидов с клетками-мишенями (рецепторные или нерецепторные)?

1.2. Синтез регуляторных пептидов
Размеры пептидных молекул, т. е. количества аминокислотных остатков в пептидных цепочках, определяют существенные различия в способах их проникновения сквозь биологические барьеры (В) и воздействия на клетки-мишени (Г). Ниже будет показано, что порог значительных изменений названных свойств пептидов составляет от четырех до пяти аминокислотных остатков. Поэтому в настоящей работе, в отличие от общепринятой классификации, мы будем обозначать пептиды как короткие (короткоцепочечные пептиды) только в том случае, если они состоят из двух-четырех аминокислот, т. е. если они являются ди-, три- и тетрапептидами. Все остальные пептиды будут рассматриваться как длинные (длинноцепочечные) пептиды.
Рибосомальный синтез белков-предшественников и их расщепление
Белки, синтезируемые в клетках макроорганизма и бактериальных клетках, в соответствии с Центральной догмой молекулярной биологии, т. е. ДНК→ мРНК → (рибосома + тРНК + аминокислоты) → белок, расщепляются ферментами в определенных сайтах протеолиза. Это означает, что пептидные связи разрушаются в определенных мотивах (комбинациях аминокислотных остатков) [10] и в определенном порядке [12].
Этот процесс называется ограниченным протеолизом и состоит из следующих стадий:
- Удаление гидрофобного N-концевого сигнального пептида, который отвечает за перенос молекулы белка, предназначенной для экспорта из полирибосомы, на поверхность грубого эндоплазматического ретикулума.
- Протеолитическое расщепление связей между некоторыми аминокислотными остатками и образование пептидов различного размера.
- Посттрансляционные модификации некоторых аминокислотных остатков в образующихся пептидах (фосфорилирование, ацетилирование и др.)
Классические участки ферментативного расщепления белковой молекулы представлены комбинациями двух положительно заряженных диаминомонокарбоновых кислот [60, 63], т. е. Lys-Arg (KR), Arg-Arg (RK) или Lys-Lys (KK). В различных тканях пропорции расщепления на таких участках варьируют от почти равных долей до значительного преобладания пептидных связей, расщепленных в сторону С-конца от аргинина (Lys-Arg или Arg-Arg) [16, 47, 65]. Иногда расщепление происходит внутри мотива Arg-X-Lys/Arg-Arg (RXK/RR) [47]. Реже расщепляются пептидные связи, включающие только одну основную аминокислоту, Arg или Lys [60]; однако такие случаи важны для образования короткоцепочечных регуляторных пептидов (см. ниже). Участки расщепления могут вообще не содержать аргинина, например, нейротензин расщепляется в мозге не в связях Arg-Arg (RR) и Pro-Arg (PR), но и в связях Pro-Tyr (PY) [44].

Аминокислотный состав эндогенных регуляторных пептидов, как правило, обычно отличается от среднего состава белков. Мы сравнили [30] аминокислотный состав всех белков, включенных в базу данных NIH Protein (http:www.ncbi.nlm.nih.gov/protein), которая квалифицируется как "совокупность последовательностей из нескольких источников, включая трансляции из аннотированных областей кодирования в GenBank, RefSeq и сторонних аннотациях, а также записи из SwissProt, PIR, PRF и PDB”, с аминокислотным составом более чем 150 регуляторных пептидов человека [42, 43] (табл.1). Для этого мы объединили все доступные аминокислотные последовательности в одно “слово", состоящее из 11 млрд. «букв», и рассчитали процентное содержание каждой буквы, например, А (аланин), С (цистеин) и т. д. То же было проделано и с аминокислотными последовательностями 155 регуляторных пептидов.
Таблица 1. Средние аминокислотные составы ( % ) белков, включенных в базу данных NIH Protein, и регуляторных пептидов человека*
| Аминокислота | Все белки | Регуляторные пептиды человека |
| лейцин, L | 9,82 | 9,60 |
| аланин, A | 8,63 | 5,96 |
| глицин, G | 7,05 | 8,77 |
| серин, S | 6,86 | 7,54 |
| валин, V | 6,70 | 4,38 |
| глутаминовая кислота, E | 6,23 | 4,07 |
| изолейцин, I | 5,82 | 3,28 |
| треонин, T | 5,60 | 4,03 |
| аргинин, R | 5,51 | 7,66 |
| аспарагиновая кислота, D | 5,41 | 4,23 |
| лизин, K | 5,29 | 6,28 |
| пролин, P | 4,78 | 6,00 |
| аспарагин, N | 4,12 | 3,24 |
| фенилаланин, F | 3,99 | 5,73 |
| глутамин, Q | 3,94 | 4,78 |
| тирозин, Y | 3,05 | 4,38 |
| метионин, M | 2,39 | 2,41 |
| гистидин, H | 2,21 | 3,00 |
| триптофан, W | 1,30 | 1,94 |
| цистеин, C | 1,30 | 2,72 |
*Расчеты были выполнены д-ром Д.Ю. Кормильцем (Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург).
Обоснованность приведенного выше сравнения ограничена тремя соображениями:
- Сравниваются два образца несопоставимых размеров: сумма аминокислотных остатков в белках в 106 раз больше, чем в регуляторных пептидах.
- Данные по всем белкам разных биологических видов сравниваются с данными по регуляторным пептидам только человека.
- В используемых базах данных недостаточно представлены некоторые важные классы белков, например, мембранные, которые труднее изолировать, чем цитоплазматические белки [38].
Со всеми вышеперечисленными оговорками можно заключить следующее:
- По сравнению с белками, регуляторные пептиды (в данном случае длинноцепочечные) содержат больше аминокислот G, S, R, K, P, F, Q, Y, H, M, W, C и меньше L, A, V, E, T, I, D, N.
- Аминокислоты, наиболее распространенные в белках, наименее распространены в регуляторных пептидах, и наоборот.
Наибольшая разница (1: 2) наблюдается в содержании цистеина (Cys, C), который необходим для образования дисульфидной (S-S) связи, необходимой для стабилизации конформации полипептида.
Причина относительно высокого содержания глицина (Gly, G) в регуляторных пептидах, вероятно, заключается в том, что благодаря своей простой структуре он не препятствует конформационным изменениям и тем самым облегчает формирование соответствующих пространственных конфигураций.
В целом можно сделать вывод о том, что основная масса наиболее распространенных аминокислот в находится в функционально неактивных доменах белков.
Короткоцепочечные регуляторные пептиды, созданные в Санкт-Петербургском институте биорегуляции и геронтологии (пептиды Хавинсона®), содержат только семь из 20 протеиногенных аминокислот, и сравнительные показатели присутствия их в пептидах таковы: E > D > G = K = W > A = R. Наиболее распространенными, согласно этому рейтингу, являются отрицательно заряженные (при рН = 7) глутаминовая кислота (Glu, E) и аспарагиновая кислота (Asp, D).

Нерибосомальный синтез пептидов
Пептидное связывание аминокислот вне рибосом приводит к образованию de novo регуляторных пептидов, в том числе короткоцепочечных, таких как карнозин (Ala-His, AH) и глутатион (Glu-Cys-Gly, ECG) (см. [36, 39]).
Фриц Липманн, лауреат Нобелевской премии по физиологии или медицине за 1953 г., показал, что нерибосомальный ферментативный синтез часто встречается у микроорганизмов, продуцирующих пептидные антибиотики [40]; пептиды нерибосомального происхождения, обнаруженные у животных и человека, могут продуцироваться микроорганизмами, а не клетками макроорганизма. Этот феномен изучен, главным образом, на антимикробных пептидах, полученных из бактерий, попадающих в желудочно-кишечный тракт в составе пищевых продуктов, таких как молоко или мед [9, 10]. Некоторые количества пептидов нерибосомального происхождения могут быть обнаружены в самих пищевых продуктах, и некоторые короткоцепочечные пептиды такого рода могут проникать во внутреннюю среду человеческого организма свозь кишечный барьер (см. ниже).
Характерной особенностью пептидов нерибосомального происхождения является то, что их протеиногенные аминокислоты могут быть гликозилированными, ацилированными, галогенированными или гидроксилированными; они также могут нести N-метильные или N-формильные группы. Кроме того, такие пептиды часто содержат необычные или непротеиногенные аминокислоты (см. [36]) и D-аминокислоты.
Молекулы таких пептидов часто имеют циклическую структуру. Например, почвенные грибы Tolypocladium inflatum синтезируют циклический ундекапептид циклоспорин нерибосомальным способом [7]. Первичная структура циклоспорина А [27] может быть представлена в упрощенном виде следующим образом:
cyclo(Leu-Val-Thr-Abu-Sar-Leu-Val-Leu-Ala-ala-Leu).
Здесь аббревиатуры, обозначающие непротеиногенные аминокислоты, выделены полужирным шрифтом:
Abu = α-аминомасляная кислота (непротеиногенная);
Sar = саркозин (промежуточный и побочный продукт в синтезе глицина);
и ala = D-Ala = D-аланин.
Нерибосомальный синтез создает не только короткоцепочечные пептиды, такие как карнозин и глутатион, но в микроорганизмах он может создавать пептидные молекулы, состоящие из нескольких десятков аминокислот, как это было рассмотрено в нескольких работах (см. [22]).
Неоднократно выдвигалась гипотеза, что нерибосомальный синтез является древним способом производства пептидов, который в ходе эволюции был заменен более прогрессивным рибосомальным синтезом. Возможно, так и было. Однако остается открытым вопрос о том, когда и каким образом появились нерибосомальные пептидные синтетазы (NRPSs), то есть белки, продуцируемые в рибосомах и необходимые для синтеза нерибосомальных пептидов.
Что касается регуляторных пептидов в головном мозге, то глутатион, продукт синтеза нерибосомальных белков, обнаружен связанным с синаптическими мембранами в головном мозге млекопитающих [26, 50] и считается кандидатом на роль нейромедиатора [24]. Однако Мишель Кретьен и его коллеги из Монреальского университета еще в 1970-х годах выдвинули предположение, ставшее впоследствии общепринятым, что все нейропептиды синтезируются в виде белковых молекул-предшественников, которые затем фрагментируются ферментами [10].

1.3. Продуценты регуляторных пептидов
Регуляторные пептиды, происходящие из просвета кишки
Кишечник как источник регуляторных пептидов (рис. 1) имеет второстепенное значение в отношении длинных молекул и, скорее всего, большое значение в отношении короткоцепочечных пептидов. Пептиды появляются в просвете кишки в результате: протеолиза пищевых белков (рис. 1 A) и синтетической активности кишечной микробиоты (рис. 1 C) [2].
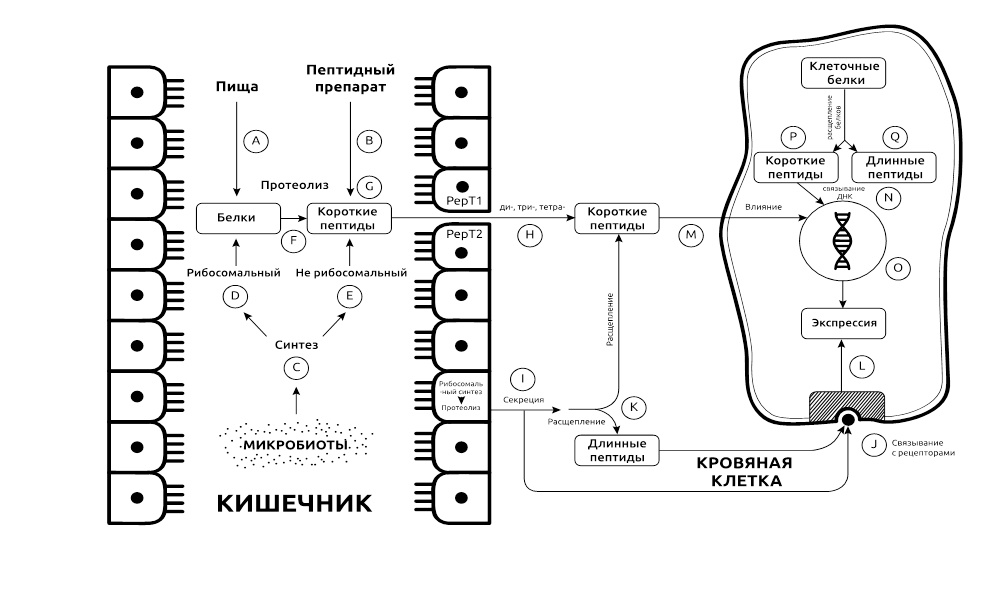
Рис. 1. Система пептидной регуляции: основные элементы.
Белки пищи расщепляются кишечными ферментами до тетра -, три- и дипептидов. Ди-и три— и, в меньшей степени, тетрапептиды всасываются в кровоток. В зависимости от их аминокислотного состава, пептиды более или менее устойчивы к дальнейшему протеолизу. Менее резистентные пептиды, которые количественно преобладают, расщепляются до аминокислот, тогда как более резистентные могут играть роль гуморальных регуляторных факторов.
Микроорганизмы, обитающие в толстой кишке и, в меньших количествах, в тонкой кишке, могут синтезировать: белки в своих рибосомах (рис. 1 D) и пептиды нерибосомальным способом (рис. 1 E). Последние привлекают внимание исследователей преимущественно в контексте влияния патогенных микроорганизмов на биоту кишечника и на состояние организма [59].
Белки, синтезируемые в микробных рибосомах, содержат те же протеиногенные аминокислоты, что и белки, содержащиеся в пищевых белках. Обе группы белков расщепляются (рис. 1 F) тем же арсеналом панкреатических пептидаз. После этого короткоцепочечные пептиды, происходящие как из пищи, так и из микробиоты, можно рассматривать как единый пул (рис. 1 G).
Среди продуктов их пищеварения выделяют короткоцепочечные пептиды, такие как глицил-глицин Gly-Gly, глицил-карнозин Gly-Sar, карнозин β-Ala-His и другие, которые из кишечника могут выходить в кровоток [1].
Регуляторные пептиды, выделяемые непосредственно в кровь
Третий, после пищи и микробиоты, источник регуляторных пептидов составляют эндокринные железы и диффузная нейроэндокринная система, которая представлена в основном эндокринными клетками в слизистой оболочке тонкой кишки [56]. Во всех вышеперечисленных клетках происходят следующие процессы: (а) рибосомальный синтез белков, включая белки — предшественники пептидов; (б) ограниченный протеолиз белков до пептидов, часть которых являются регуляторными; и (в) высвобождение регуляторных пептидов в кровь (рис. 1 I). Некоторые из длинноцепочечных пептидов вскоре связываются со своими рецепторами на поверхности клеток-мишеней (рис. 1 J), тогда как другие расщепляются в крови и интерстициальной жидкости на более мелкие фрагменты (рис. 1 K), которые также связываются со специфическими рецепторами (рис. 1 J).
Связавшись со специфическими рецепторами, пептиды запускают сквозь системы вторичных мессенджеров (рис. 1 L) цепочки биохимических событий, которые в конечном итоге проявляются в виде эффектов на клеточном и тканевом уровнях.

Синтетические аналоги регуляторных пептидов в качестве лекарственных препаратов
Короткоцепочечные регуляторные пептиды могут поступать в организм и в виде синтетических препаратов, принимаемых перорально (per os) в качестве лекарственных средств (см. гл. 5). Это четвертый возможный источник регуляторных пептидов (рис. 1 B).
Независимо от их происхождения короткоцепочечных регуляторных пептидов (из пищевых продуктов, микробиоты, эндокринные клеток или лекарственных препаратов), дальнейшая судьба всех этих молекул имеет общие черты, а потому участие в физиологической регуляции как эндогенных, так и экзогенных пептидов можно рассматривать с общих позиций.

Регуляторные пептиды, продуцируемые самими клетками-мишенями
Теоретически регуляторные пептиды могут образовываться путем расщепления клеточных белков, присутствующих в плазматической мембране, цитоплазме, ядерной оболочке и нуклеоплазме. Например, ниже будет показано, что мотив AEDG (пептиды эпифиза) состоит из белка, связанного с механизмами аутофагии, который присутствует во многих органах человеческого организма, включая ЦНС [41, 57].
Короткоцепочечные пептиды (рис. 1 P), образующиеся в результате протеолиза собственных белков клетки, могут связываться с ДНК (рис. 1 N), тогда как длинноцепочечные пептиды (рис. 1 Q) того же происхождения могут оставить свою клетку-продуцент и связаться с рецепторами (рис. 1 J) на поверхности той же клетки (аутокринный механизм действия). В противном случае они могут связывать соседние клетки (паракринный механизм) или удаленные клетки (эндокринный механизм).
Транспорт регуляторных пептидов сквозь барьеры
Транспорт пептидов сквозь барьеры осуществляется белками bp суперсемейства главных фасилитаторов (major facilitator superfamily — MSF), которое включает подсемейство протонзависимых (или связанных) олигопептидных транспортеров (proton-dependent or proton-coupled oligopeptide transporters — OPTs), способных распознавать и переносить более 8000 различных пептидов [54].
Система поглощения короткоцепочечных пептидов, в том числе тетрапептидов, обнаружена у бактерии Sinorhizobium melitoti [49]. Транспортер тетрапептидов Isp4 обнаружен в делящихся дрожжах Schizosaccharamyces pombe и считается незаменимым для этих клеток [34]. В почкующихся дрожжах Saccharamyces cerevisia описана транспортная система для олигопептидов длиной в 4-5 аминокислот (OligoPeptide Transport — OPT) [67]. PcORT14, ортолог OPT, способен опосредовать поглощение тетрапептида KLGL клетками дрожжей Saccharamyces cerevisia [68]. OPT, специфичные для три-и пентапептидов, обнаружены в грибах и растениях [52]. Наличие таких транспортных систем прослеживается филогенетически от бактерий и грибов до позвоночных [14].

Транспорт пептидов сквозь кишечный барьер
Короткоцепочечные пептиды образуются в результате ограниченного протеолиза белков, как собственных, так и пищевых, которые в небольших количествах переходят из тонкой кишки в кровь [69].
При ферментативном расщеплении пищевых белков существует теоретическая возможность образования короткоживущих фрагментов, структура которых сходна с регуляторными длинноцепочечными пептидами; однако сомнительно, что столь крупные молекулы были способны проникать сквозь кишечный барьер.
Вполне возможно, что кишечный барьер проницаем для циклических пептидов. Например, аргинин-вазопрессин (CYFQNCPRG) частично всасывается и сохраняет свою физиологическую активность при всасывании [48, 61]. В связи с этим возникают два вопроса: много ли циклических длинноцепочечных пептидов в просвете кишки и имеют ли они какое-либо значение для системной гуморальной регуляции?
Как было указано выше, расщепление белков и пептидов в просвете кишки (независимо от того, является ли их происхождение пищевым или микробным) заканчивается на стадии короткоцепочечных пептидов (рис. 1 G), которые способны проникать сквозь кишечный барьер и попадать в интерстициальную жидкость и кровь.
Трипептид Ala-Gly-Gly (AGG) и некоторые дипептиды не гидролизуются в тонкой кишке. Транспортные системы для переноса дипептидов сквозь кишечный барьер не строго специфичны, так как при одновременном введении в просвет кишки двух дипептидов транспорт каждого из них оказывается менее интенсивным, чем при введении одного [1].
Транспортеры пертидов локализуются на щеточных мембранах эпителиальных клеток кишечника [64]. Они переносят ди— и трипептиды сквозь кишечный барьер [5, 64]. Pept1 (рис. 1 H) действует как электрогенный протон- и трипептидный симпортер и переносит любые ди-и трипептиды, но не свободные аминокислоты и не тетрапептиды или еще более крупные молекулы [13, 35]. Однако у птиц было показано, что Pept2 переносит и тетрапептиды [66]

Транспорт пептидов сквозь гематоэнцефалический барьер
Длинноцепочечные регуляторные пептиды, синтезированные вне мозга, оказывают свое действие на центральную нервную систему путем связывания со специфическими рецепторами, локализованными на вагусных афферентах (чувствитель ных волокнах блуждающего нерва) и на внешней поверхности мозга, и лишь в редких случаях благодаря их проникновению сквозь гематоэнцефалический барьер в паренхиму мозга за счет специфической транспортной системы [43]. В то же время короткоцепочечные пептиды, такие как TPPT, могут действовать, попадая в мозг [46]. Например, считается, что тетрапептид Tyr-MIF-1 (YPLG) проникает в мозг путем диффузии сквозь гематоэнцефалический барьер [53]
Транспорт пептидов сквозь клеточные и ядерные мембраны: длинноцепочечные пептиды, проникающие в клетку
У куриных эмбрионов экспрессия мРНК транспортных систем Pept1 и Pept2 обнаруживается не только в тонкой кишке, но и в головном мозге, сердце, легких и почках [72]. Pept2 обнаружен в срезах мозга крыс [25].
Некоторые тетрапептиды способны проходить сквозь клеточные мембраны без участия Pepts (рис. 1 M); например, эта способность показана для синтетического опиоидного тетрапептида [Dmt1]DALDA (Dmt-D-Arg-Phe-Lys-NH2, где Dmt-2',6' — диметилтирозин) [70].
В конце 1980-х годов исследователи, работавшие на медицинском факультете Университета Джона Хопкинса, обнаружили, что белок транс-активатор транскрипции (Tat) вируса иммунодефицита человека (ВИЧ) способен проникать в клетки и влиять на экспрессию генов [19, 21]. Именно тогда было открыто семейство проникающих в клетки пептидов (cell-penetrating peptides — CPPs) [11, 20].
Полагают, что CPPs можно будет использовать в качестве эффективного и нетоксичного средства для доставки в клетки малых интерферирующих РНК (siRNA) [15] — мощного инструмента для модуляции генной экспрессии с помощью РНК-интерференции (RNAi) [58]. Следует подчеркнуть, что CPPs являются не только переносчиками других молеул в клетки извне, но и сами могут быть регуляторными пептидами, то есть могут производить физиологические эффекты, влияя на экспрессию генов.
Большинство CPPs являются длинноцепочечными пептидами, такими как нонапептид R6W3 или октадекапептид PVEC (табл. 2). CPPs широко распространены в вирусах человека. Например, белки оболочки вируса Т-клеточного лейкоза человека и вируса иммунодефицита человека ВИЧ-1 содержат примерно по 200 копий мотива GRKKRRQRRRPPQ, известеного как Tat-пептид.
Таблица 2. Некоторые проникающие в клетку пептидные мотивы [6] и биологические виды, чьи белки содержат такие мотивы [30]
| Происхождение | Пептид | Первичная структура | Кол-во мотивов** | Образцы видов, имеющих мотив, обнаруженный в их белках |
| Белкового происхождения | Пенетратин (16)* | RQIKIWFQNRRMKWKK | 1204 | человек, горилла, шимпанзе, макака, слон, овца, свинья, летучая мышь, утконос, саккоглосс Ковалевского, пиявки, клещи и т. д. |
| Tat-пептид (13) | GRKKRRQRRRPPQ | 447 | вирус Т-клеточного лейкоза человека, вирус иммунодефицита человека-1 | |
| PVEC (18) | LLIILRRRIRKQAHAHSK | 1 | домовая мышь | |
| Синтетические | Полиаргинины (7-11) | (R)n 6 < n < 12 |
273 (R11) | человек, кошка, собака, дрозофила, токсоплазма, дрожжи, гидра, ячмень, рис, пшеница, кукуруза, персик, Ancylostoma ceylanicum, Acanthamoeba castellanii, Acetobacter pasteurianus и т. д |
| MAP (18) | KLALKLALKALKAALKLA | 0 | не найдено | |
R6W3 (9) |
RRWWRRWRR | 3 | рис, Gregarina niphandrodes |
* В скобках указано количество аминокислотных остатков в мотиве.
** Общее количество мотивов, найденных в NIH Protein Database.
Среди синтетических CPPs следует отметить декапептид полиаргинин (R)11 [6]. Было обнаружено, что некоторые животные белки содержат и более длинные монотонные мотивы, состоящие исключительно из остатков аргинина (R...R) [30]. Например, переносчик многочисленных вирусных заболеваний комар Aedes albopictus имеет белок, в котором 100 остатков аргинина следуют подряд.
Химерные CPPs, а именно Transportan (n=27), MPG (n=27) и Pep-1 (n=21), которые упоминаются в [6], до сих пор не найдены в природных белках [30].
Способность проникать сквозь клеточные мембраны характерна для коротких фрагментов Tat-белка (активатора транскрипции ВИЧ-1). Часто они являются основными, т. е. содержат в избытке положительно заряженные аминокислотные остатки. Преимущество этих пептидов заключается в том, что они легко проходят кислый слой гликокаликса, прилегающий к плазматической мембране [37]. Показано, что синтетические основные и амфифильные пептиды, содержащие несколько остатков лизина, проникают не только в клетку, но и в ядро, где они образуют комплексы с ДНК и РНК [31-33].
Непосредственное взаимодействие пептида с клеточной мембраной определяется электростатическими силами между положительно заряженными боковыми цепями остатков аргинина (R) и лизина (K) и отрицательно заряженными карбоксильными фрагментами фосфатидилсерина, находящимися на внешней стороне плазматической мембраны. Центрами связывания отрицательно заряженных (карбоновых) боковых цепей пептидов являются положительно заряженные холиновые и этаноламиновые фрагменты фосфолипидов. Другим возможным механизмом проникновения короткоцепочечных пептидов сквозь плазматические мембраны является пиноцитоз [11].
В число CPPs также входят короткие синтетические пептиды, такие как пептид тимуса (KE) и пептиды эпифиза (AEDG) [4].

Короткоцепочечные пептиды Хавинсона как CPPs
Под влиянием пептидов мозга (AEDP) состояние хроматина в культивируемых клетках изменяется. Было показано, что пептиды мозга проход сквозь плазматическую и ядерную мембраны и влияет на активность генов [3].
Пептиды эпифиза, коры головного мозга (EDR) и бронхов (AEDL) преимущественно связываются с CNG-содержащими последовательностями ДНК, которые являются мишенями для метилирования цитозина в эукариотической ДНК. Пептиды эпифиза, семенников (KEDG) и мозга, похоже, связываются преимущественно с CAG-, в то время как пептиды бронхов— с CTG-содержащими последовательностями. Сайт-специфические взаимодействия пептидов с ДНК могут эпигенетически контролировать клеточные функции и, по-видимому, играют важную роль в регуляции активности генов от самых ранних стадий биологической эволюции до настоящего времени [17].
Короткоцепочечные пептиды, прошедшие сквозь клеточную и ядерную мембраны, могут регулировать экспрессию генов и синтез белка, стимулировать пролиферацию и дифференцировку клеток, подавлять апоптоз, восстанавливая тем самым функции различных органов [28, 29, 32].
Было показано, что пептиды эпифиза, мозга и семенников, меченные FITC, присутствуют в ядрах и ядрышках клеток HeLa после их инкубации с пептидами в течение 12 ч [18].
Известно, что ядро эукариотической клетки имеет систему транспортных пор (нуклеопор), образованных белковыми комплексами нуклеопоринов. Внутренний диаметр нуклеопор составляет около 50 нм, следовательно, они проницаемы для свободно диффундирующих низкомолекулярных веществ массой до 3,5 кДа, к числу которых можно отнести короткоцепочечные пептиды. Это позволяет обсуждать возможность непосредственного взаимодействия короткоцепочечных пептидов с ДНК [51].

1.4 Рецепторные и нерецепторные взаимодействия пептидов с клетками-мишенями
Рецепторно-опосредованные взаимодействия
Несмотря на огромный фармацевтический интерес к деталям взаимодействия регуляторных пептидов с их специфическими рецепторами на клеточных мембранах, эти детали до сих пор остаются малоизученными. Данные о связывании около десятка пептидов с рецепторами, встроенными в мицеллы додецилфосфохолина, позволяют предположить, что: (i) при связывании с его рецептором лиганд может взаимодействовать с липидным бислоем вокруг рецептора; (ii) взаимодействие с клеточными мембранами включает от 4 до 12 аминокислотных остатков пептида, которые входят в состав от 4 до 33 длинных аминокислотных сегментов его молекул, и только от 4 до 5 длинных аминокислотных мотивов полностью взаимодействуют с мембраной.
Нерецепторные взаимодействия
Рецепторно-неопосредованные взаимодействия более характерны для короткоцепочечных регуляторных пептидов, которые способны проникать сквозь клеточную и ядерную мембраны (рис. 1 M) и путем укладки в большую бороздку молекулы ДНК (рис. 1 N) могут влиять на транскрипцию строго определенных генов (см. гл. 3). Это — один из основных принципов эпигенетической регуляции физиологических функций с помощью пептидов (рис. 1 O). Механизм будет более подробно рассмотрен в гл. 3; однако в целом он соответствует следующей схеме [45]:
CPPs → экспрессия генов → синтез белка → физиологические изменения (например, старение)
Хотя физиологическое значение пептидных связей широко признано, роль пептидов, особенно короткоцепочечных, в физиологической регуляции недооценена. Регуляция, включающая отдельные аминокислоты, возможно, действует довольно рано в эволюции прокариот. Например, известно регуляторное действие аминокислот на пролиферацию бактерий. С появлением пептидных связей у природы появилась возможность записывать в молекулу гораздо больше информации для передачи к клетке-мишени. Это обеспечивает более тонкую регуляцию функций клеток.

Резюме
Регуляторные пептиды возникают в основном в результате ферментативного расщепления белков-предшественников, синтезируемых в рибосомах. Что касается короткоцепочечных пептидов, то нельзя исключать и нерибосомальный механизм их синтеза.
Основными продуцентами регуляторных пептидов являются нейросекреторные клетки, присутствующие во всех органах, но, главным образом, в кишечнике, эндокринных железах и головном мозге. Часть пептидов может появиться в просвете кишки вследствие расщепления пищевых белков и синтеза микробиотой как рибосомальных, так и нерибосомальных белков. Возможно также, что регуляторные пептиды образуются в самих клетках-мишенях в результате синтеза белков-предшественников и их последующего ферментативного расщепления.
Существуют специальные системы для активного транспорта регуляторных пептидов сквозь биологические барьеры, включая кишечную стенку, гематоэнцефалический барьер, клеточные и ядерные мембраны. Регуляторные пептиды могут проникать в клетки-мишени по тому же механизму, что и пептиды из группы CPPs.
Воздействие длинноцепочечных регуляторных пептидов на клетки-мишени в значительной степени опосредуется связыванием со специфическими рецепторами на поверхности клеток. Короткоцепочечные пептиды могут действовать нерецепторными путями, проникая в клетку и ее ядро, связываясь с молекулами ДНК и изменяя экспрессию генов (эти темы будут рассмотрены более подробно в главах 3 и 4).
Из-за способности короткоцепочечных пептидов взаимодействовать с ДНК рецепторно-неопосредованным способом их роль в физиологической регуляции гораздо более значительна, чем это было признано до сих пор.
Литература
- Addison JM, Burston D, Dalrympe JA, Matthews DM, Payne JW, Sleisenger MH, Wilkinson S. A common mechanism for transport of di- and tri-peptides by hamster jejunum in vitro. Clin Sci Mol Med. 1975;49(4):313-22.
- Al-Hassi HO, Mann ER, Sanchez B, English NR, Peake ST, Landy J, Man R, Urdaci M, Hart AL, Fernandez-Salazar L, Lee GH, Garrote JA, Arranz E, Margolles A, Stagg AJ, Knight SC, Bernardo D. Altered human gut dendritic cell properties in ulcerative colitis are reversed by Lactobacillus plantarum extracellular encrypted peptide STp. Mol Nutr Food Res. 2014;58(5):1132-43.
- Anisimov SV, Bokheler KR, Khavinson VKh, Anisimov VN. Elucidation of the effect of brain cortex tetrapeptide Cortagen on gene expression in mouse heart by microarray. Neuro Endocrinol Lett. 2004;25(1/2):87-93.
- Anisimov VN, Khavinson VKh. Peptide bioregulation of aging: results and prospects. Biogerontology. 2010;11:139-49.
- Beale JH, Parker JL, Samsudin F, Barrett AL, Senan A, Bird LE, Scott D, Owens RJ, Sansom MS, Tucker SJ, Meredith D, Fowler PW, Newstead S. Crystal Structures of the extracellular domain from PepT1 and PepT2 provide novel insights into mammalian peptide transport. Structure. 2015;23(10):1889-99.
- Bechara C, Sagan S. Cell-penetrating peptides: 20 years later, where do we stand?. FEBS Letters. 2013;587(12):1693–702.
- Borel JF. History of the discovery of cyclosporin and of its early pharmacological development. Wien Klin Wochenschr. 2002;114(12):433-7.
- Caminero A, Herrán AR, Nistal E, Pérez-Andrés J, Vaquero L, Vivas S, Ruiz de Morales JM, Albillos SM, Casqueiro J. Diversity of the cultivable human gut microbiome involved in gluten metabolism: Isolation of microorganisms with potential interest for coeliac disease. FEMS Microbiol Ecol. 2014;88(2):309-19.
- Chaudhry V, Chauhan PS, Mishra A, Goel R, Asif MH, Mantri SS, Bag SK, Singh SK, Sawant SV, Nautiyal CS. Insights from the draft genome of Paenibacillus lentimorbus NRRL B-30488, a promising plant growth promoting bacterium. J Biotechnol. 2013;168(4):737-8.
- Chrétien M, Benjannet S, Gossard F, Gianoulakis C, Crine P, Lis M, Seidah NG. From beta-lipotropin to beta-endorphin and „pro-opio-melanocortin“. Can J Biochem. 1979;57(9):1111-21.
- Chugh A, Eudes F, Shim YS. Cell-penetrating peptides: Nanocarrier for macromolecule delivery in living cells. IUBMB Life. 2010;62(3):183-93.
- Conlon JM. Biosynthesis of regulatory peptides — evolutionary aspects. In: Holmgren S, editor. The Comparative Physiology of Regulatory Peptides. Chapman & Hall. 1989.
- Daniel H. Molecular and integrative physiology of intestinal peptide transport. Annu Rev Physiol. 2004;66:361-84.
- Daniel H, Spanier B, Kottra G, Weitz D. From bacteria to man: Archaic proton-dependent peptide transporters at work. Physiology (Bethesda). 2006;21:93-102.
- Dash-Wagh S, Langel Ü, Ulfendahl M. PepFect6 mediated SiRNA delivery into organotypic cultures. Methods Mol Biol. 2016;1364:27-35.
- Dickerson IM, Mains RE. Cell-type specific posttranslational processing of peptides by different pituitary cell lines. Endocrinology. 1990;127(1):133-40.
- Fedoreyeva LI, Kireev II, Khavinson VKh, Vanyushin BF. Penetration of short fluorescence-labeled peptides into the nucleus in HeLa cells and in vitro specific interaction of the peptides with deoxyribooligonucleotides and DNA. Biochemistry (Moscow), 2011;76(11):1210-19.
- Fedoreeva LI, Smirnova TA, Kolomijtseva GYa, Khavinson VKh, Vanyushin BF. Interaction of short peptides with FITC-labeled wheat histones and their complexes with deoxyribooligonucleotides. Biochemistry (Moscow). 2013;78(2):166-75.
- Frankel AD, Pabo CO. Cellular uptake of the tat protein from human immunodeficiency virus. Cell. 1988;55:1189–93.
- Fuchs SM, Raines RT. Pathway for polyargenine entry into mammalian cells. Biochemistry. 2004;43:2438 — 44.
- Green M, Loewenstein PM. Autonomous functional domains of chemically synthesized human immunodeficiency virus tat trans-activator protein. Cell. 1988;55:1179–1188.
- Grünewald J, Marahiel MA. Nonribosomally synthesized microbial macrocyclic peptides. In: Kastin AJ, editor. Handbook of Biologically Active Peptides. Amsterdam: Academic Press, 2006.
- Guettou F, Quistgaard EM, Trésaugues L, Moberg P, Jegerschöld C, Zhu L, Jong AJ, Nordlund P, Löw C. Structural insights into substrate recognition in proton-dependent oligopeptide transporters. EMBO Rep. 2013;14(9):804-10.
- Guo N, McIntosh C, Shaw C. Glutathione: new candidate neuropeptide in the central nervous system. Neuroscience. 1992;51(4):835-42.
- Hu Y, Xie Y, Keep RF, Smith DE. Divergent developmental expression and function of the proton-coupled oligopeptide transporters PepT2 and PhT1 in regional brain slices of mouse and rat. J Neurochem. 2014;129(6):955-65.
- Janáky R, Shaw CA, Varga V, Hermann A, Dohovics R, Saransaari P, Oja SS. Specific glutathione binding sites in pig cerebral cortical synaptic membranes. Neuroscience. 2000;95(2):617-24.
- Kallen J, Mikol V, Taylor P, Walkinshaw MD. X-ray structures and analysis of 11 cyclosporin derivatives complexed with cyclophilin A. J Mol Biol. 1998;283:435-49.
- Khavinson VKh. Peptidergic Regulation of Ageing. Humanistica, St Petersdburg. 2009.
- Khavinson VKh. Peptides, genome, aging. Adv Gerontol. 2014;4(4):337–45.
- Khavinson VKh, Kormiletz DYu, Maryanovich AT. Peptides (epigenetic regulators) in the structure of proteins long- and short-lived rodents. Bull Exper Biol Med. 2017;163(5):671-6.
- Khavinson VKh, Solov’ev AYu, Tarnovskaya SI, Lin’kova NS. Mechanism of biological activity of short peptides: Cell penetration and epigenetic regulation of gene expression. Biol Bull Rev. 2013;3(6):451–5.
- Khavinson VKh, Solov’ev AYu, Zhilinskii DV, Shataeva LK, Vanyushin BF. Epigenetic aspects of peptide-mediated regulation of aging. Adv Gerontol. 2012;2(4):277–86.
- Khavinson VKh, Tarnovskaya SI, Linkova NS, Pronyaeva VE, Shataeva LK, Yakutseni PP. Short cell-penetrating peptides: a model of interactions with gene promoter site. Bull Exper Biol Med. 2013;154(3):403-10.
- Kitamura K, Nakase M, Tohda H, Takegawa K. The Ubiquitin ligase Ubr11 is essential for oligopeptide utilization in the fission yeast Schizosaccharomyces pombe. Eukaryot Cell. 2012;11(3):302-10.
- Klang JE, Burnworth LA, Pan YX, Webb KE Jr, Wong EA. Functional characterization of a cloned pig intestinal peptide transporter (pPepT1). J Anim Sci. 2005;83(1):172-81.
- Klompus M, Ho W, Sharkey KA, McKay DM. Antisecretory effects of neuropeptide Y in the mouse colon are region-specific and are lost in DSS-induced colitis. Regul Pept. 2010;165(2-3):138-45.
- Kubo T, Yanagihara K, Sato Y, Morita Y, Seyama T. Enhancement of gene silencing effect and membrane permeability by peptide-conjugated 27-nucleotide small interfering RNA. Molecules. 2012;17(9):11089-102.
- Langelaan DN, Rainey JK. Membrane catalysis of peptide-receptor binding. Biochem Cell Biol. 2010;88(2):203-10.
- Li H, Xu H, Graham DE, White RH. Glutathione synthetase homologs encode α-L-glutamate ligases for methanogenic coenzyme F420 and tetrahydrosarcinapterin biosyntheses. Proc Natl Acad Sci U S A. 2003;100(17):9785-90.
- Lipmann F. Attempts to map a process evolution of peptide biosynthesis. Science. 1971;173(4000):875-84.
- Liu TT, Hu CH, Tsai CD, Li CW, Lin YF, Wang JY. Heat stroke induces autophagy as a protection mechanism against neurodegeneration in the brain. Shock. 2010;34(6):643-8.
- Maryanovich AT. Early stages of phylogenesis of peptide regulation. J Evol Biochem Physiol. 2014;50(5):460-71.
- Maryanovich AT. Foundations of Peptide Regulation of the Physiological Functions: Blood-Brain Barrier and Evolution of Viscera-to-Brain Communications / Mechinkov North-Western State Medical University, 2014. (Russian, English).
- McDermott JR, Smith AI, Edwardson JA, Griffiths EC. Mechanism of neurotensin degradation by rat brain peptidases. Regul Pept. 1982;3(5-6):397-404.
- Micans P. The new Russian peptide revolution. Aging Matters. 2016. (Spec 25 yrs ann edit):6-9.
- Moskal JR, Kuo AG, Weiss C, Wood PL, O'Connor Hanson A, Kelso S, Harris RB, Disterhoft JF. GLYX-13: a monoclonal antibody-derived peptide that acts as an N-methyl-D-aspartate receptor modulator. Neuropharmacology. 2005;49(7):1077-87.
- Nagahama M, Ikemizu J, Misumi Y, Ikehara Y, Murakami K, Nakayama K. Evidence that differentiates between precursor cleavages at dibasic and Arg-X-Lys/Arg-Arg sites. J Biochem. 1991;110(5):806-11.
- Natochin YuV, Prutskova NP. Absorption of functionally active arginine-vasotocin in the frog small intestine. Dokl Biol Sci. 2004;394:24-6.
- Nogales J, Muñoz S, Olivares J, Sanjuán J. Genetic characterization of oligopeptide uptake systems in Sinorhizobium meliloti. FEMS Microbiol Lett. 2009;293(2):177-87.
- Ogita K, Yoneda Y. Possible presence of [3H]glutathione (GSH) in synaptic membranes from rat brain. Neurosci Res. 1987;4(6):486-96.
- Ohno M, Fornered M, Mattaj IW. Nucleocytoplasmic transport: the last 200 nanometers. Cell. 1998;92(2):327-36.
- Osawa H, Stacey G, Gassmann W. ScOPT1 and AtOPT4 function as proton-coupled oligopeptide transporters with broad but distinct substrate specificities. Biochem J. 2006;393(Pt 1):267-75.
- Pan W, Kastin AJ. From MIF-1 to endomorphin: the Tyr-MIF-1 family of peptides. Peptides. 2007;28(12):2411-34.
- Parker JL, Mindell JA, Newstead S. Thermodynamic evidence for a dual transport mechanism in a POT peptide transporter. Elife. 2014;3. doi: 10.7554/eLife.04273.
- Pessione E. Lactic acid bacteria contribution to gut microbiota complexity: lights and shadows. Front Cell Infect Microbiol. 2012;2:86.
- Polak JM, Bloom SR. The diffuse neuroendocrine system. Studies of this newly discovered controlling system in health and disease. J Histochem Cytochem. 1979;27(10):1398-1400.
- Ribas VT, Schnepf B, Challagundla M, Koch JC, Bähr M, Lingor P. Early and sustained activation of autophagy in degenerating axons after spinal cord injury. Brain Pathol. 2015;25(2):157-70.
- Roberts TC, Ezzat K, El Andaloussi S, Weinberg MS. Synthetic SiRNA delivery: Progress and prospects. Methods Mol Biol. 2016;1364:291-310.
- Schneditz G, Rentner J, Roier S, Pletz J, Herzog KA, Bücker R, Troeger H, Schild S, Weber H, Breinbauer R, Gorkiewicz G, Högenauer C, Zechner EL. Enterotoxicity of a nonribosomal peptide causes antibiotic-associated colitis. Proc Natl Acad Sci U S A. 2014;111(36):13181-6.
- Schwartz TW. The processing of peptide precursors. 'Proline-directed arginyl cleavage' and other monobasic processing mechanisms. FEBS Lett. 1986;200(1):1-10.
- Selivestrova EV, Shakhmatova EI, Komissarchik YaYu, Prutskova NP, Snigirevskaya ES, Natochin YuV. Immunocytochemical localization of vasopressin at its absorption by cells of rat small intestine. Tsitologiia. 2004;46(11):953-9.
- Shao D, Massoud E, Clarke D, Cowley E, Renton K, Agu RU. Optimization of human nasal epithelium primary culture conditions for optimal proton oligopeptide and organic cation transporters expression in vitro. Int J Pharm. 2013;441(1-2):334-42.
- Stoller TJ, Shields D. The role of paired basic amino acids in mediating proteolytic cleavage of prosomatostatin. Analysis using site-directed mutagenesis. J Biol Chem. 1989;264(12):6922-8.
- Terada T, Inui K. Recent advances in structural biology of peptide transporters. Curr Top Membr. 2012;70:257-74.
- Thorne BA, Thomas G. An in vivo characterization of the cleavage site specificity of the insulin cell prohormone processing enzymes. J Biol Chem. 1990;265(15):8436-43.
- Van L, Pan YX, Bloomquist JR, Webb KE Jr, Wong EA. Developmental regulation of a turkey intestinal peptide transporter (PepT1). Poult Sci. 2005;84(1):75-82.
- Wiles AM, Cai H, Naider F, Becker JM. Nutrient regulation of oligopeptide transport in Saccharomyces cerevisiae. Microbiology. 2006;152(Pt 10):3133-45.
- Xiang Q, Wang Z, Zhang Y, Wang H. An oligopeptide transporter gene family in Phanerochaete chrysosporium. Gene. 2013;522(2):133-41.
- Zakutskiĭ AN, Chalisova NI, Ryzhak GA, Aniskina AI, Filippov SV, Zeziulin PN. The tissue-specific effect of synthetic peptides-biologic regulators in organotypic tissues culture in young and old rats. Adv Gerontol. 2006;19:93-6.
- Zhao K, Luo G, Zhao GM, Schiller PW, Szeto HH. Transcellular transport of a highly polar 3+ net charge opioid tetrapeptide. J Pharmacol Exp Ther. 2003;304(1):425-32.
- Zhao X, de Jong A, Zhou Z, Kuipers OP. Complete genome sequence of Bacillus amyloliquefaciens strain BH072, isolated from honey. Genome Announc. 2015;3(2). pii: e00098-15.
- Zwarycz B, Wong EA. Expression of the peptide transporters PepT1, PepT2, and PHT1 in the embryonic and posthatch chick. Poult Sci. 2013;92(5):1314-21.