Пептиды как эпигенетические факторы

Содержание
1.1. Эпигенетический подход к проблеме старения
В последние годы исследователи все чаще признают важность факторов, способных влиять на экспрессию генов, но не связанных непосредственно с последовательностями ДНК. Это признание согласуется с биологической дисциплиной, известной как эпигенетика, которая занимается наследуемыми и потенциально обратимыми изменениями в экспрессии генов, вызванными модификациями гистонов и/или метилированием ДНК. У промоторов генов образуются различные комбинации транскрипционных факторов, обеспечивающих специфичность экспрессии генов. Транскрипты генов могут быть нацелены на сотни микро-РНК, объединенных с другими белками и РНК, которые участвуют в посттранскрипционной регуляции экспрессии генов [15]. Только около половины составляющих человеческих хромосом — это ДНК. Остальная часть состоит из белков, несущих эпигенетические метки, которые определяют изменения в активности и экспрессии генов [13, 14].
Можно влиять на старение, изменяя экспрессию генов с модуляторами транскрипции, чтобы компенсировать возрастные генетические изменения [11, 21]. Например, короткоцепочечные пептиды Хавинсона могут проникать в ядра клеток и изменять экспрессию генов и синтез белка [17, 38]. Общая последовательность событий, вызванных короткоцепочечными пептидами, выглядит следующим образом [55]:
а) комплементарное взаимодействие между короткоцепочечным пептидом и ДНК;
б) деконденсация хроматина;
в) изменения в конформации и экспрессии генов;
г) синтез тканеспецифических белков;
д) пролиферация и дифференцировка клеток;
е) регуляция биохимических и физиологических процессов.
Молекулярные механизмы взаимодействия короткоцепочечных пептидов с ДНК подробно описаны в гл. 3.
Короткоцепочечные пептиды дифференцированно модулируют расщепление ДНК эндонуклеазами, и этот эффект опосредуется гистонами. Пептиды находят места в хроматине, где они могут взаимодействовать с ДНК, причем их доступность определяется в основном гистонами. Влияние пептидов на активность эндонуклеаз может быть определено дифференциальной специфичностью связывания пептидов с ДНК, а также специфичностью самих ферментов [18, 37].
Старение изменяет экспрессию генов, кодирующих регуляторные пептиды. Возникающие в результате этого регуляторные дисбалансы могут быть устранены с помощью пептидных биорегуляторов. Они улучшают энергоснабжение тканей, снижают генерацию активных форм кислорода и улучшают возрастные изменения иммунных, эндокринных и других функций [39].
Старение связано с повышением экспрессии генов, продукты которых участвуют в воспалении. В то же время снижается экспрессия генов, участвующих в регуляции клеточной энергетики, дифференцировке и пролиферации. Воспаление вносит значительный вклад в патогенез возрастных нарушений. Восприимчивость к воспалению является результатом иммунного дисбаланса, в частности нарушения функций Т-клеток. В целом это приводит к снижению способности живых организмов противостоять многим инфекциям и злокачественным опухолям, заболеваемость которыми значительно возрастает с возрастом. Еще одним фактором повышенной онкологической заболеваемости является нарушенный контроль пролиферации и дифференцировки клеток, что не только способствует развитию рака, но и нарушает гомеостаз, регенерацию тканей и их функциональную активность. Последние подвергаются риску также из-за нарушения механизмов выработки энергии митохондриями. Кроме того, эти нарушения связаны с увеличением выработки активных форм кислорода, которые повреждают ткани и способствуют развитию рака, атеросклероза и возрастных неврологических расстройств. Наиболее важными среди изменений клеточной дифференцировки являются те, которые происходят в нейроэндокринных органах, влияющих на многочисленные физиологические функции. Вышеизложенное делает обоснованным изучение молекулярно-генетических механизмов действия геропротекторных пептидов [8, 17, 21].
Взаимодействие короткоцепочечных пептидов Хавинсона с ДНК носит эпигенетический характер [39, 44]. Пептидные биорегуляторы участвуют в тканеспецифической регуляции экспрессии генов и синтеза белка. Их действие на клеточном уровне проявляется в снижении темпов накопления патологических изменений, таких как повреждения ДНК, мутации, злокачественная трансформация и др., а также усиливается активность репаративных процессов, которые восстанавливают клеточный гомеостаз [29].
Вилон (KE) и эпиталон (AEDG) стимулируют экспрессию генов, кодирующих компоненты дыхательной цепи митохондрий. Эти пептиды, а также кортаген (AEDP) вызывают более чем двукратное повышение уровней митохондриальных генов, кодирующих 16S-субъединицу рибосом, NADH-дегидрогеназу-1, цитохром С-оксидазу 1, NADH-дегидрогеназу-4, NADH-дегидрогеназу-5 и цитохром В [37, 39].
Среди генов, активность которых изменяется при введении пептидов организмам, есть те, которые отвечают за структуру и подвижность клеток, системы защиты клеток, восприятие и трансдукцию сигналов. Не менее важным является влияние пептидов на цитокины, такие как IL-1β, IL-2, IL-6, IL-17A, TNFα и INF-γ [22, 42, 53], которые определяют активность как клеточной, так и гуморальной ветвей приобретенного иммунитета.
В отличие от генетических мутаций, эпигенетические изменения потенциально обратимы. Это дает основания полагать, что пептидные биорегуляторы, обладающие эпигенетической активностью, могут способствовать нормализации функций генов, нарушенных вследствие нарушения метилирования.
Пептидные препараты, полученные из тканей и органов (см. гл. 2) способны при введении экспериментальным животным стимулировать синтез белка в органах их происхождения тканеспецифическим способом [22].
Тканеспецифические эффекты проявляются не только пептидными препаратами, полученными из тканей молодых животных, но и некоторыми короткоцепочечными (ди -, три- или тетра-) пептидами, выделенными из препаратов или синтезированными искусственно, в том числе короткоцепочечными пептидами Хавинсона. Такие короткоцепочечные пептиды обладают сродством к органам и тканям, где они накапливаются и проявляют самую высокую биологическую активность.
Короткоцепочечные пептиды Хавинсона индуцируют синтез белка в клетках органов, которые были источниками пептидных препаратов и аминокислотные композиции которых использовались при конструировании соответствующих пептидов. Например, панкраген (KEWD) индуцирует экспрессию факторов дифференцировки CXCL12, Hoxa3 и WEGC в клетках поджелудочной железы, бронхоген (AEDL) делает это в бронхиальном эпителии, а везуген (KED) — в фибробластах и т. д. Такие эффекты наиболее выражены в "старых" клеточных культурах, что позволяет предположить, что они могут быть вовлечены в геропротекторную активность пептидов [19, 39]. Эпиталон и вилон производят четкие тканеспецифические эффекты на пинеальную железу и вилочковую железу соответственно.
Было показано, что панкраген увеличивает экспрессию металлопротеиназ (MMP2, MMP9), серотонина, гликопротеина CD79a, антиапоптотического белка Mcl-1 и маркеров пролиферации PCNA и Ki67. Панкраген ингибирует экспрессию проапоптотического белка р53 в "старых" культурах клеток поджелудочной железы [36].
Бронхоген регулирует синтез белков Ki67, Mcl-1, p53, CD79 и NOS-3 в культурах клеток бронхиального эпителия человека в разных пассажах. Это может способствовать усилению клеточного обновления и увеличению функциональной активности бронхиального эпителия за счет бронхогена [19].
Везуген в культуре кортикальных тимоцитов человека стимулировал дифференцировку клеток в сторону регуляторных Т-клеток, повышал их пролиферативную активность и снижал апоптоз. Везуген стимулировал пролиферацию (оцениваемую по экспрессии Ki67) и антиапоптотическую (Mcl-1) активность зрелых регуляторных Т-клеток. Он усиливал экспрессию маркера миелоидных клеток CD14 и антигена В-лимфоцитов CD19 в костном мозге [32, 54].
Добавление эпиталона к культуре пинеалоцитов стимулировало экспрессию арилалкиламин-N-ацетилтрансферазы (AANAT) и транскрипционного фактора pCREB, участвующего в синтезе мелатонина из серотонина. Содержание мелатонина в питательной среде повышалось [4 - 6, 9, 10, 25]. Было показано, что эпиталон и вилон ингибируют запрограммированную гибель лимфоцитов селезенки у крыс [23].
Короткоцепочечные пептиды Хавинсона (ди-, три- и тетрапептиды) проявляли выраженную тканеспецифическую активность в клеточных культурах как молодых, так и старых экспериментальных животных (рис.10).

Рис. 10. Тканеспецифические эффекты пептидов Хавинсона.
* p<0,05 по сравнению с контролем.
+Статистически значимый эффект.
Такие тканеспецифические эффекты были обнаружены у животных всех возрастов, начиная с внутриутробных периодов жизни. Например, добавление вилона или эпиталона к культурам эмбриональных клеток сетчатки активировало экспрессию белков Brn3, Pax6, Prox1 и Vsx1. Эти пептиды стимулируют дифференцировку нейронов и клеток пигментного эпителия сетчатки и поэтому могут рассматриваться как потенциальные ретинопротекторные препараты для лечения возрастных дегенеративных изменений сетчатки [33]. Добавление короткоцепочечного пептида к плюрипотентным клеткам эктодермы ранней гаструлы лягушки Xenopus laevis привело к появлению различных тканей [28].
Показано, что введение эпиталона и вилона трансгенным мышам подавляет в 2,0 — 3,6 раза, соответственно, экспрессию гена HER-2/neu, который, как известно, связан с повышением риска развития рака молочной железы у человека, и значительно уменьшает размер опухоли [7].
Промоторные области генов, кодирующих IL-2, IL-5, IL-6, IL-17A, TNFα и IFNγ, содержат участки связывания вилона, представленные последовательностями GCAG и CGTC [45].
Rардиоген (AEDR) усиливал экспрессию белков цито- и кариоскелета в культивируемых эмбриональных фибробластах. Этот пептид увеличивал экспрессию цитоскелетных белков (актина, тубулина и виментина) в 2-5 раз, а ядерных белков (ламина А, ламина С) — в 2-3 раза. Молекулярный механизм действия этого тетрапептида основан на его способности активировать синтез белков цито- и кариоостова, что усиливает пролиферацию клеток и снижает апоптоз [27].
1.2. Эпигенитическое действие короткоцепочечных пептидов на органы и ткани
Многочисленные исследования показали, что гены являются мишенями для ди -, три- и терапептидов [17, 24, 29, 37, 39]. Это позволяет дать таким пептидам название цитогены. Некоторые эффекты цитогенов, конструкция которых основана на исследованиях пептидных препаратов, полученных из тканей организма, ограничены соответствующими тканями [39].
Сердце
Среди 15247 генов, экспрессия которых в сердце мышей была изучена с помощью библиотеки кДНК, предоставленной Национальным институтом старения (National Institute of Aging) США, 180 были либо повышены, либо понижены вилоном, 242 — эпиталоном и 144 — обоими пептидами (рис. 11) [1, 3].
Было обнаружено, что эпиталон, вилон и тимоген влияют на экспрессию ядерных и митохондриальных генов в здоровых сердцах взрослых мышей. От 1,25 до 1,74% всех изученных генов изменяли свою экспрессию под действием какого-либо из этих пептидов. Прирост составил до 6,61 раза по сравнению с контролем, а снижение — в пределах 3,06 раза. Среди генов, затронутых пептидами, были и те, которые участвуют в метаболической регуляции, транскрипции генов и пролиферации клеток [29].
Рис. 11. Влияние вилона (KE) и эпиталона (AEDG) на экспрессию генов в сердце мышей. Исследование было проведено в сотрудничестве с Национальным институтом старения, Балтимор, США.
Мозг
Транскриптомные исследования проводились с образцами мозга мышей, получавших эпиталон. Среди 16 897 генов, входящих в состав библиотеки кДНК, использованной в исследовании, 53 показали значительные изменения в их экспрессии под действием эпиталона, включая 22 случая индуцированной экспрессии. Известно, что гены, на которые влияет эпиталон, участвуют в клеточном цикле, апоптозе, синтезе нуклеиновых кислот, их переработке и транспорте, а также активации хроматина [1, 3, 31].
После однократного интраназального введения вилона крысам было обнаружено увеличение мРНК IL-2 в гипоталамусе с использованием метода гибридизации заблокированных аминокислот in situ. Это открытие является доказательством эпигенетического механизма действия вилона [16].
Через 2 ч после интраназального введения вилона количество положительных клеток IL-2 уменьшилось в гипоталамических структурах крыс, которые не были адаптированы к умеренному стрессу, связанному с передачей и помещением в клетки во время эксперимента. У крыс, которые были приспособлены к обращению, такой реакции на вилон не наблюдалось.
Однократное интраназальное введение кортагена (AEDP, 10 мкл раствора 10 нг/мл в каждую ноздрю) было связано с заметным повышением уровня мРНК IL-2 в гипоталамических ядрах LHA, DMH, и VMH [16].
Было обнаружено, что кортаген ускоряет регенерацию поврежденных нейронов и усиливает проводимость нервных импульсов в регенерирующих афферентных нервных волокнах [58].
Инъекции эпиталона и кортагена крысам снижали содержание продуктов ПОЛ и снижали окислительную модификацию белков, что сопровождалось подавлением антиоксидантной активности в коре головного мозга крыс [43].
Сетчатка глаза
Было обнаружено, что эпиталон стимулирует рост эксплантов сетчатки животных и запускает пролиферацию клеток в культурах пигментированного эпителия [35, 41].
У крыс Кэмпбелла, имеющих наследственную дистрофию пигментного эпителия, парабульбарное введение эпиталона (по 0,1 мкг в каждый глаз) проводили ежедневно с рождения и до 72 дней жизни. В период с 17 по 35-е сутки общая изоэлектрическая активность, определяемая методом электроретинографии, повышалась до уровней, которые были в 7 раз выше, чем у контрольных крыс. У контрольных крыс на 43-й день не было зарегистрировано активности ЭРГ, тогда как у крыс, получавших эпиталон, она могла быть зарегистрирована до 62-го дня после рождения. Эпиталон способствовал сохранению морфологической структуры сетчатки глаза [34, 35]. Вероятно, этот эффект был возможен благодаря способности эпиталона связываться с PIRE или другими участками ДНК или с факторами транскрипции (см. гл. 3).
Добавление эпиталона к плюрипотентным клеткам эктодермы ранней гаструлы лягушки Xenopus laevis привело к появлению клеток ретинального и пигментного эпителия [28, 30].
Эндокринная система
У гипофизэктомированных цыплят в возрасте 1, 21 или 40 дней повышалась свертываемость крови, ингибировался фибринолиз, снижалось количество лейкоцитов (в том числе лимфоцитов) в крови, снижалось количество антителообразующих клеток и цитотоксическая активность лейкоцитов в селезенке, снижались уровни тиреотропина, три- и тетрайодтиронинов в крови. Одновременно с перечисленными изменениями развились дегенеративные изменения в тимусе, бурсе и щитовидной железе. Эти реакции на гипотизэктомию были менее выражены у цыплят в возрасте 1 года и у старых (5 лет). Введение эпиталона (0,1 мг/кг массы тела) гипофизэктомированным цыплятам в течение 40 дней, начиная с 5-го дня после операции, улучшало эти показатели независимо от возраста. Поведение получавших эпиталон гипофизэктомированных цыплят мало чем отличалось от поведения ложно оперированных цыплят того же возраста [46-48].
Шишковидная железа
Лимфоидный компонент шишковидной железы в органотипических культурах представлен преимущественно недифференцированными CD5+ лимфоцитами. Вилон стимулировал дифференцировку этих предшественников в Т-хелперы, цитотоксические Т-лимфоциты и В-клетки. Эпиталон стимулировал дифференцировку клеток-предшественников в органотипической культуре лимфоидного компонента шишковидной железы в сторону В-клеток [51].
Легкие: бронхиальный эпителий
Установлено, что бронхоген регулирует экспрессию белков Ki67, Mcl-1, p53, CD79, NOS-3 в культурах клеток бронхиального эпителия человека в различных пассажах и усиливает обновление клеток и функциональную активность в бронхиальном эпителии. В клеточных культурах при их третьем пассаже (”молодая“), седьмом пассаже (”зрелая“) и четырнадцатом пассаже (”старая") бронхоген увеличивался в 1,55, 2,44 и 3,42 раза, соответственно, в тех областях, где обнаруживалась экспрессия Ki67 (табл. 9). Площади экспрессии Mcl-1 увеличивались бронхогеном в 1,41 и 1,89 раза в “зрелой” и “старой” культурах соответственно. Апоптоз, оцениваемый по экспрессии белка р53, снижался бронхогеном на 38, 22 и 32% в “молодых”, “зрелых” и “старых” культурах бронхиальных клеток соответственно [19]. Поскольку экспрессия р53 в контрольных культурах повышается при старении клеток, происходящем в процессе перехода от третьего к четырнадцатому пассажу, способность бронхогена ингибировать апоптоз можно рассматривать как один из механизмов геропротекторной активности пептида.
Способность бронхогена повышать экспрессию трансмембранного гликопротеина CD79 позволяет предположить, что этот пептид способен регулировать местные иммунные реакции. В присутствии бронхогена площадь экспрессии CD79 увеличивалась в ”молодой“, ”зрелой“ и ”старой " культурах на 18, 85 и 41%, соответственно. Бронхоген снижал экспрессию NOS-3, фермента, который модулирует клеточные реакции в ”старых“ культурах клеток бронхиального эпителия.
Таблица 9. Влияние бронхогена (AEDL) на площади (% от общей площади), где можно было бы обнаружить экспрессию белковых маркеров функциональной активности культур клеток бронхиального эпителия человека
|
Маркер |
Экспериментальная группа |
Пассаж |
||
|
3 (“молодой”) |
7 (“зрелый”) |
14 (“старый”) |
||
|
Ki67 |
контроль |
4.21±0.05 |
4.15±0.07 |
4.07±0.12 |
|
бронхоген |
6.52±0.07* |
10.12±0.34* |
13.92±0.41* |
|
|
Mcl-1 |
контроль |
2.63±0.07 |
2.41±0.06 |
2.38±0.09 |
|
бронхоген |
3,72±0.06* |
4.55±0.13* |
4.51±0.11* |
|
|
p53 |
контроль |
4.82±0.09 |
5,31±0.13 |
5.96±0.23 |
|
бронхоген |
3.01±0.07* |
4.14±0.11* |
4.07±0.17* |
|
|
CD79 |
контроль |
0.61±0.05 |
0.33±0.06 |
0.54±0.07 |
|
бронхоген |
0.72±0.09* |
0.61±0.07* |
0.76±0.06* |
|
|
NOS-3 |
контроль |
8.72±0.06 |
9.04±0.07 |
9.13±0.08 |
|
бронхоген |
8.65±0.09 |
9.11±0.10 |
8.31±0.09* |
|
*p<0,05 по сравнению с соответствующим контролем.
Далее было изучено влияние бронхогена на экспрессию генов, участвующих в ранней и поздней дифференцировке клеток бронхиального эпителия, и их функциональную активность. Было обнаружено, что бронхоген активирует экспрессию этих генов в “молодых” и “зрелых” культурах и не оказывает никакого эффекта в “старых” культурах. В “молодых” культурах экспрессия генов Nkx2.1 и SCGB1A1 повышалась соответственно в 1,59 и 2,58 раза под действием бронхогена. В “зрелых” культурах клеток бронхиального эпителия экспрессия всех изученных генов (Nkx2.1, SCGB1A1 и SCGB3A2) увеличилась в 1,65, 1,42 и 2,00 раза, соответственно. Таким образом, бронхоген эпигенетически стимулирует ранние стадии дифференцировки клеток бронхиального эпителия. Бронхоген вызывал 10,3-кратное увеличение экспрессии FoxA2 в ”молодых " клеточных культурах, а также 1,50- и 2,17-кратное увеличение экспрессии FoxA1 и FoxA2, соответственно, в зрелых культурах. Примечательно, что продукт гена FoxA1 регулирует активность секретогранина SCGB1A1 [40].
Таблица 10. Влияние бронхогена (AEDL) на экспрессию генов, участвующих в дифференцировке клеток и функциональной активности бронхиального эпителия человека
|
Ген |
Экспериментальная группа |
Пассаж |
|
|
3 (“молодой”) |
7 (“зрелый”) |
||
|
Nkx2.1 |
контроль |
1,10±0,10 |
0,82±0,10 |
|
бронхоген |
1,75±0,20* |
1,35±0,20* |
|
|
SCGB1A1 |
контроль |
0,60±0,05 |
0,60±0,10 |
|
бронхоген |
1,55±0,10* |
0,85±0,10* |
|
|
SCGB3A2 |
контроль |
1,75±0,20 |
0,60±0,10 |
|
бронхоген |
1,60±0,20 |
1,20±0,10* |
|
|
FoxA1 |
контроль |
1,95±0,15 |
0,90±0,10 |
|
бронхоген |
1,90±0,20 |
1,35±0,10* |
|
|
FoxA2 |
контроль |
0,15±0,02 |
0,60±0,10 |
|
бронхоген |
1,55±0,10* |
1,30±0,10* |
|
|
MUC4 |
контроль |
2,00±0,20 |
0,75±0,15 |
|
бронхоген |
1,70±0,20 |
1,65±0,10* |
|
|
MUC5AC |
контроль |
1,20±0,10 |
1,00±0,10 |
|
бронхоген |
1,80±0,20* |
1,05±0,10 |
|
|
SftpA1 |
контроль |
1,00±0,10 |
0,90±0,05 |
|
бронхоген |
1,65±0,10* |
1,50±0,10* |
|
Примечание: *p<0,05 по сравнению с соответствующим контролем. Результаты, которые выражаются в условных единицах, были получены методом количественной полимеразной цепной реакции. Интеркалатный флуоресцентный краситель SYBR зеленый-1 (QuantiFast SYBR Green PCR Kit, QIAGEN, Германия) и амплификатор CFX96 (Real-Time PCR Detection System, BioRad Laboratories, Inc., США).
Бронхоген активирует экспрессию генов, характеризующихся тем, что снижение их активности коррелирует с развитием различных патологических состояний в легких. В ”молодых " культурах клеток экспрессия генов MUC5AC и SfptA1 повышалась соответственно в 1,50 и 1,65 раза под действием бронхогена.
Возможно, бронхоген влияет только на FoxA1, и что кажущееся увеличение SCGB1A1 является вторичным. С другой стороны, нельзя исключать, что бронхоген непосредственно активирует оба гена. Кроме того, поскольку FoxA2 участвует в дифференцировке клеток и развитии тканей, эпигенетическая регуляция FoxA2 бронхогеном может нарушать основы онтогенеза. Данные, представленные выше, предполагают, что этот тетрапептид может связываться с линкерными и коровыми гистонами, некоторые из которых взаимодействуют с FoxA2.
Изменения в синтезе белка SP-A1 (продукт гена SftpA1) коррелируют с дыхательными функциями у больных хроническим бронхитом. Активируя экспрессию генов MUC4, MUC5AC и SftpA1, бронхоген может предотвратить развитие патологических состояний в легких. Было показано, что бронхоген стимулирует экспрессию MUC4 и SftpA1 в 2,20 и 1,67 раза, соответственно, в ”зрелых" клеточных культурах (см. табл. 10). Эти данные особенно важны, поскольку в раковых тканях было обнаружено снижение экспрессии MUC4. Снижение экспрессии MUC5AC приводит к недостаточному синтезу муцина и, таким образом, ставит под угрозу защиту легких от инфекций. В культурах бронхиальных клеток человека бронхоген активирует экспрессию генов Nkx2.1, SCGB1A1, SCGB3A2, FoxA1, FoxA2, которые участвуют в дифференцировке клеток бронхиального эпителия. Пептид также увеличивает экспрессию генов MUC4, MUC5AC и SftpA1, снижение экспрессии которых коррелирует с развитием хронического бронхита [40].
В совокупности вышеизложенное позволяет предположить, что механизмы генной регуляции бронхогена включают сигнальные каскады, и они реализуются через несколько стадий на генетическом, субклеточном и клеточном уровнях.
Легкие: легочные фибробласты
Добавление эпиталона (AEDG) к культурам фибробластов легких человека индуцирует ген теломеразы и активность теломеразы, что связано с увеличением длины теломер в 2,40 раза и увеличением числа удвоений клеток в 1,42 раза. Обработанные эпиталоном фибробласты с удлиненными теломерами были способны к 10 дополнительным делениям. Эпиталон способствует увеличению продолжительности жизни диплоидных клеток человека за счет превышения предела Хейфлика [20].
В обработанных эпиталоном культурах клеток шишковидной железы молодых и старых экспериментальных животных наблюдалось увеличение синтеза экспрессии белков MMP2 и Ki67 и снижение экспрессии проапоптотического белка р53 [6].
Почки
Пептиды карталакс (AED) и оваген (EDL) не влияли на экспрессию Ki67a в “старых” культурах почечных клеток (рис. 12).

Рис. 12. Влияние карталакса и овагена на экспрессию сигнальных молекул в диссоциированных культурах почечных клеток на 14-м пассаже (“старые" культуры клеток).
*p<0,05 по сравнению с контролем.



A B C
Рис. 13. Влияние короткоцепочечных пептидов на экспрессию р53 в культурах почечных клеток при 14-м пассаже (“старые" культуры клеток). A: Контроль; B: карталакс; CВ: оваген. Иммуноцитохимия, ×200.
Карталакс (AED) снижал экспрессию р53 в “старых” культурах в 1,33 раза (см. рис. 12 и 13). Экспрессия IL-8 не изменялась при добавлении пептидов к культурам. Известно, что изменения экспрессии этого хемокина обычно связаны с выраженными воспалительными реакциями в почках. Поэтому вполне вероятно, что изменения экспрессии IL-8 не могут быть обнаружены в нормальных культурах клеток почечного эпителия. Оваген (EDL) увеличивал в 1,52 раза экспрессию желатиназы ММП14 в ”старых" культурах почечных клеток. В то же время карталакс и пептидные экстракты, полученные из почек, не производили такого эффекта.
Карталакс и оваген стимулируют рост органотипических культур почечной ткани у молодых и старых экспериментальных животных. Изучено влияние карталакса и овагена на экспрессию маркеров почечной патологии в стареющих культурах почечных клеток. Оба пептида влияют на экспрессию сигнальных молекул, синтез которых изменяется в почках при патологических состояниях. Однако молекулярные мишени пептидов различны. Например, эффекты карталакса были однонаправленными и выражались в почти двукратном увеличении пролиферативной активности клеток и 1,5-кратном снижении апоптоза в стареющих культурах клеток почечного эпителия. Для овагена мишенью является желатиназа MMP14. Его экспрессия в почечном эпителии повышается этим пептидом в 1,5 раза. В то же время оваген не влияет на пролиферацию и апоптоз клеток в культурах почечных клеток.
Кожа
Короткоцепочечные пептиды Хавинсона повышают экспрессию каспазы-3 — маркера апоптоза, в “старых” (14 пассажей) культурах фибробластов кожи крыс больше, чем в “молодых” (3 пассажа) культурах. Карталакс снижает скорость апоптоза как в “молодых”, так и в “старых” культурах, а эпиталон делает это в “старых” культурах в меньшей степени, чем в “молодых” [52].
Проведено сравнение влияния эпиталона, вилона, карталакса и везугена на экспрессию маркеров клеточного обновления и ремоделирования внеклеточного матрикса в культурах фибробластов кожи в процессе их старения. Указанные пептиды увеличивали экспрессию Ki67 в “молодых” культурах в 1,14, 1,89, 1,40 и 2,08 раза соответственно (рис. 14) [52].

Рис. 14. Влияние короткоцепочечных пептидов на пролиферацию и апоптоз клеток в ”молодых“(3 пассажа) и ”старых" (14 пассажей) культурах фибробластов кожи крыс. AED — карталакс; KED — везуген; KE — вилон; AEDG — эпиталон.
*p<0,05 по сравнению с контрольными ”молодыми" культурами; **p<0,05 по сравнению с контрольными ”старыми" культурами.
Для качественной оценки способности фибробластов кожи ремоделировать внеклеточный матрикс в качестве маркера использовали MMP9. В контрольных “молодых” культурах экспрессия MMP9 была в 4,24 раза ниже, чем в контрольных “старых” культурах. Ни один из исследуемых пептидов (эпиталон, вилон, карталакс и везуген) не влиял на экспрессию MMP9 в “молодых” культурах фибробластов. В “старых” культурах эти пептиды снижали экспрессию MMP9 в 3,43, 2,88, 4,50 и 1,29 раза, соответственно (рис. 15) [52].

Рис. 15. Влияние пептидов на обновление клеток и ремоделирование внеклеточного матрикса фибробластов кожи крыс в процессе их старения. *р<0,05 по сравнению с контрольными ”молодыми "культурами клеток; ** р<0,05 по сравнению с контрольными ”старыми" культурами клеток.
Экспрессия CD98hc, маркера функциональной активности клеток кожи, была в 2,92 раза выше в “молодых“ культурах, чем в ”старых". В присутствии эпиталона, вилона, карталакса и везугена экспрессия CD98hc увеличивалась соответственно в 1,66, 1,49, 1,22 и 2,94 раза в “молодых” культурах и в 2,38, 3,90, 1,62 и 6,75 раза в “старых” культурах [52].
Влияние пептидов на апоптоз в фибробластах кожи изучали с использованием ”старых“ и ”молодых" клеточных культур. Экспрессия каспазы-3 была в 3,8 раза выше в “молодых” культурах, чем в “старых”. Карталакс снижал экспрессию каспазы-3 в 1,43 раза в “молодых” культурах, тогда как эпиталон, вилон и везуген не влияли на нее. В “старых” культурах эпиталон и карталакс снижали экспрессию каспазы-3 в 2,52 и 5,05 раза соответственно (рис. 16), тогда как вилон и везуген не оказали на него существенного влияния (см. рис. 13) [52].

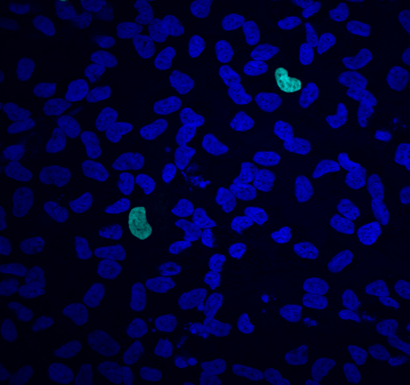
A B
Рис. 16. Иммунофлуоресценция культур фибробластов кожи 14-го пассажа. Конфокальная микроскопия (×200). Ядра клеток окрашены Hoechst 33258 (темно-синяя флуоресценция). Светло-голубая флуоресценция — окрашиванием на каспазу-3. A: Контрольные культуры, B: Культуры, обработанные эпиталонои (AEDG).
Наблюдение, что в ”старых" культурах фибробластов кожи экспрессия MMP9 выше, чем в ”молодых" культурах, согласуется с активацией ремоделирования внеклеточного матрикса и воспалительных процессов с увеличением возраста. Эпиталон, вилон, карталакс и везуген снижали экспрессию MMP9 в “старых“, но не в ”молодых" культурах.
Иммунная система, Тимус
Тимус, центральный орган иммунной системы, претерпевает инволюцию в процессе старения, как это показано на рис. 17.


|
Возрастная группа |
Оптическая плотность (условные единицы) |
Область экспрессии (процент) |
|
1: 6 мес. — 4 года |
2,05±0,06 |
3,36±1,54 |
|
2: 65 — 79 лет |
0,54±0,02* |
1,24±0,06* |
|
3: 80 — 95 лет |
0,39±0,01* |
0,99±0,03* |
|
*р<0,05 по сравнению с группой 1 |
||
Иммунофлуоресценция в образцах, визуализируемых методом лазерной конфокальной микроскопии, ×400 (красная флуоресценция: родамин G; зеленая флуоресценция: FITC).
Рис. 17. Экспрессия транскрипционных белков PAX 1 в эпителиальных клетках тимуса человека. Исследование проведено в сотрудничестве с Центром исследований Принца Фелипе (Centro de Investigación Príncipe Felipe — CIPF), Валенсия, Испания.
Эпиталон in vitro значительно увеличивал сывороточный тимусный фактор в супернатанте стромы тимуса у мышей разного возраста и долю CD+ клеток в суспензии костного мозга у старых мышей [49, 50].
Добавление эпиталона в культуральную среду тимоцитов и эпителиальных клеток на вторые сутки после посева подавляло экспрессию аргирофильных белков и образование рибосом и тем самым снижало синтез белка. Эти данные свидетельствуют о том, что транскрипционная активность рибосомных генов и пролиферативная активность клеток были снижены эпиталоном [56].
Добавление вилона к культивируемым тимоцитам человека и крысы увеличивало экспрессию CD5, маркера дифференцировки лимфоцитов. Вилон индуцировал дифференцировку предшественников Т-клеток в сторону CD4+ Т-хелперов [57].
В тимоцитах вилон (KE) стимулирует экспрессию аргирофильных белков в областях ядрышкового организатора. Эти белки отвечают за синтез, сборку и транспорт рибосом в цитоплазму, и поэтому их экспрессия должна усиливать синтез белка. Вилон, вероятно, вмешивается в регуляцию функций ядрышкового организатора и расположенных в нем рибосомных генов [56].
Вилон в дозе от 10 до 100 мкг/мл показал повышенное внутриклеточное содержание Са2+ в тимоцитах и макрофагах, что согласуется с активацией клеток.
Селезенка
Экспрессия маркеров недифференцированных CD5+ клеток, В-клеток, Т-киллеров/супрессоров и Т-хелперов была верифицирована иммуногистохимическими методами в тимусах лиц пожилого (55-60 лет) и старческого возрастов (75-90 лет), а также долгоживущих (старше 90 лет). Количество CD5+ клеток в тимусе постепенно уменьшается с возрастом. Были обнаружены положительные корреляции между количествами CD5+ и дифференцированных Т-клеток. Способность CD5+ тимоцитов дифференцироваться в Т-киллеры/супрессорные клетки снижалась с возрастом [26].
После 5 ч инкубации лимфоидных клеток из селезенки мышей в присутствии вилона уровень мРНК IL-2 в клетках повышался. Было высказано предположение, что вилон не только проникает в клетки, но и участвует в регуляции экспрессии генов. Возможно, что вилон проникает в ядра клеток или взаимодействует с трансфакторами, участвующими в активации гена IL-2 в лимфоцитах [29].
Добавление вилона к культивируемым тимоцитам человека и крысы сопровождалось повышением экспрессии маркера дифференцировки лимфоцитов CD5. Вилон индуцировал дифференцировку предшественников Т-клеток в сторону CD4+ Т-хелперов [57].
Везуген (KED), добавляемый в культуры кортикальных тимоцитов человека, увеличивал их дифференцировку в регуляторные Т-клетки и их пролиферативную активность, а также снижал скорость апоптоза. Кроме того, везуген стимулировал пролиферативную активность, оцениваемую по Ki67, и антиапоптотическую активность, оцениваемую по Mcl-1 в зрелых регуляторных Т-клетках. Также были изучены везугенные эффекты CD34+ стволовых клеток костного мозга. Была продемонстрирована способность везугена стимулировать экспрессию маркера B-клеток CD19 в костном мозге.
Резюме
К числу наиболее важных факторов, способствующих старению, относится снижение синтеза белка, что приводит к инволюции основных органов и тканей. Пептидные препараты, полученные из органов молодых животных, способны при длительном их введении в старый организм стимулировать синтез белка и тем самым восстанавливать основные функции органов тканеспецифическим образом.
Эта способность пептидных препаратов, полученных из определенных органов молодых животных, разделяется некоторыми искусственно синтезированными пептидами Хавинсона, короткоцепочечными (ди-, три- и тетра- пептидами), разработанными на основе исследований соответствующих комплексных пептидных препаратов. Добавление таких короткоцепочечных пептидов к плюрипотентным клеткам эктодермы приводит к появлению различных тканей. Эти пептиды способны индуцировать дифференцировку клеток, которая зависит от их структуры. Можно направленно индуцировать дифференцировку плюрипотентных клеток и таким образом использовать этот биологический резерв органов и тканей для продления продолжительности жизни животных и человека до их видоспецифических пределов.
Эндогенные короткоцепочечные пептиды можно рассматривать как эпигенетические факторы, выполняющие естественную регуляцию экспрессии генов. Короткоцепочечные пептиды избирательно связываются с определенными участками ДНК. Они эпигенетически регулируют экспрессию генов, включая онкогены, гены теломеразы, интерлейкинов и фактора транскрипции. Было показано, что короткоцепочечные пептиды увеличивают длину теломер в соматических клетках, усиливают пролиферацию и дифференцировку клеток, которые все более нарушаются в процессе старения, и ингибируют апоптоз. В целом эти эффекты способствуют долголетию. Экспериментальные животные, получающие такие пептиды во второй половине своей жизни, живут на 20-40% дольше.
В различных органах и тканях в принципе можно добиться целенаправленной индукции клеточной дифференцировки и тем самым активизировать клеточные резервы. Короткоцепочечные пептиды Хавинсона являются материальным средством для увеличения жизненных ресурсов организма и для увеличения средней продолжительности жизни человека до видоспецифического предела продолжительности жизни.
Литература
- Anisimov SV, Bokheler KR, Khavinson VKh, Anisimov VN. Studies of the effects of Vilon and Epithalon on gene expression in mouse heart using DNA-microarray technology. Bull Exp Biol Med. 2002;133(3):293–9.
- Anisimov SV, Bokheler KR, Khavinson VKh, Anisimov VN. Elucidation of the effect of brain cortex tetrapeptide Cortagen on gene expression in mouse heart by microarray. Neuro Endocrinol Lett. 2004;25(1/2):87-93.
- Anisimov SV, Khavinson VKh, Anisimov VN. Effect of melatonin and tetrapeptide on gene expression in mouse brain. Bull Exp Biol Med. 2004;138(5):504-9.
- Anisimov VN, Arutjunyan, AV, Khavinson, VKh. Effects of pineal peptide preparation Epithalamin on free-radical processes in humans and animals. Neuro Endocrinol Lett. 2001; 22(1): 9–18.
- Anisimov VN, Bondarenko LA, Khavinson VKh. Effect of pineal peptide preparation (Epithalamin) on life span and pineal and serum melatonin level in old rats. Ann NY Acad Sci. 1992;673:53-7.
- Anisimov VN, Khavinson VKh. Pineal peptides as modulators of aging. In: Aging Interventions and Therapies. Suresh, IS Rattan, ed.: World Sci, Singapore. 2005:127–46.
- Anisimov VN, Khavinson VKh, Provinciali M, Alimova IN, Baturin DA, Popovich IG, Zabezhinski MA, Imyanitov EN, Mancini R, Franceschi C. Inhibitory effect of the peptide epitalon on the development of spontaneous mammary tumors in Her-2/NEU transgenic mice. Int J Cancer. 2002;101:7-10.
- Anisimov VN, Morozov VG, Khavinson VKh. Increase of the life span and decrease in the tumor incidence in C3H/Sn mice as affected by thymus and epiphysis polypeptide factors. Dokl Akad Nauk SSSR. 1982;263(3):742-5.
- Anisimov VN, Mylnikov SV, Khavinson VKh. Pineal peptide preparation epithalamin increases the lifespan of fruit flies, mice and rats. Mech Ageing Dev. 1998;103:123-32.
- Anisimov VN, Mylnikov SV, Oparina TI, Khavinson VKh. Effect of melatonin and pineal peptide preparation epithalamin on life span and free radical oxidation in Drosophila melanogaster. Mech Ageing Dev. 1997;97:81-91.
- Ashapkin VV, Linkova NS, Khavinson VKh, Vanyushin BF. Epigenetic mechanisms of peptidergic regulation of gene expression during aging of human cells. Biochemistry (Moscow). 2015;80(3):310-22.
- Barabanova SV, Artyukhina ZE, Kazakova TB, Khavinson VKh, Malinin VV, Korneva EA. Interleukin-2 concentration in hypothalamic structures of rats receiving peptides during mild stress. Bull Exp Biol Med. 2006;141(4):390-3
- Collins AR, Duthie SJ. Epigenetics. Allis CD, Jenuwein T, Reinberg D, Caparros M-L, eds. Cold Spring Harbor, New York: Cold Spring Harbor Lab Press, 2007.
- Collins AR, Duthie SJ, Fillion L, Gedik CM, Vaughan N, Wood SG. Oxidative DNA damage in human cells: the influence of antioxidants and DNA repair. Biochem Soc Trans. 1997;25(1):326-31.
- Hafner M, Landthaler M, Burger L, Khorshid M, Hausser J, Berninger P, Rothballer A, Ascano M Jr, Jungkamp AC, Munschauer M, Ulrich A, Wardle GS, Dewell S, Zavolan M, Tuschl T. Transcriptome-wide identification of RNA-binding protein and microRNA target sites by PAR-CLIP. Cell. 2010;141(1):129-41.
- Kazakova TB, Barabanova SV, Novikova NS, Glushikhina MS, Khavinson VKh, Malinin VV, Korneva EA. Synthesis of IL-2 mRNA in cells of rat hypothalamic structures after injection of short peptides. Bull Exp Biol Med. 2005;139(6):718-20.
- Khavinson VKh. Peptides and ageing. Neuro Endocrinol Lett. 2002;23(Suppl. special issue).
- Khavinson VKh. Peptidergic Regulation of Ageing. Humanistica, St Petersburg. 2009.
- Khavinson VKh. Peptides, genome, aging. Adv Gerontol. 2014;4(4):337–45.
- Khavinson VKh, Bondarev IE, Butyugov AA, Smirnova TD. Peptide promotes overcoming of the division limit in human somatic cell. Bull Exp Biol Med. 2004;137(5):503-6.
- Khavinson VKh, Fedoreeva LI, Vanyushin BF. Short peptides modulate the effect of endonucleases of wheat seedling. Dokl Biochem Biophys. 2011;437(1):64–7.
- Khavinson VKh, Kuznik BI, Ryzhak GA. Peptide bioregulators: the new class of geroprotectors. Communication 1. Results of experimental studies. Adv Gerontol. 2012;25(4):696-708.
- Khavinson VKh, Kvetnoy IM. Peptide bioregulators inhibit apoptosis. Bull Exp Biol Med. 2000;130(12):1175–6.
- Khavinson VKh, Lezhava TA, Monaselidze JG, Dzhokhadze TA, Dvalishvili NA, Bablishvili NK, Ryadnova IY. Effects of Livagen peptide on chromatin activation in lymphocytes from old people. Bull Exp Biol Med. 2002;134(4):389-92.
- Khavinson VKh, Linkova NS, Kvetnoy IM, Kvetnaia TV, Polyakova VO, Korf HW. Molecular cellular mechanisms of peptide regulation of melatonin synthesis in pinealocyte culture. Bull Exp Biol Med. 2012; 153(2):255–8.
- Khavinson VKh, Linkova NS, Polyakova VO, Dudnov AV, Kvetnoy IM. Age-specific dynamics of human thymus immune cell differentiation. Bull Exp Biol Med. 2011;151(5):631-3.
- Khavinson VKh, Lin’kova NS, Polyakova VO, Kvetnoy IM, Benberin VV, D'yakonov MM, Titkov YS. Tetrapeptide H-Ala-Glu-Asp-Arg-OH stimulates expression of cytoskeletal and nuclear matrix proteins. Bull Exp Biol Med: Cell Technol Biol Med. 2012;153(4):559–62.
- Khavinson VKh, Lin’kova NS, Trofimov AV, Polyakova VO, Sevost’yanova NN, Kvetnoy IM. Morphofunctional fundamentals for peptide regulation of aging. Biol Bull Rev. 2011;1(4):390–4.
- Khavinson VKh, Malinin VV. Gerontological Aspects of Genome Peptide Regulation. Basel (Switzerland), Karger AG, 2005.
- Khavinson VKh, Malinin VV, Trofimova SV, Zemchikhina VN. Inductive activity of retinal peptides. Bull Exp Biol Med. 2002;134(5):482–4.
- Khavinson VKh, Morozov VG. Peptides of pineal gland and thymus prolong human life. Neuro Endocrinol Lett. 2003;24(3/4):233-40.
- Khavinson VKh, Polyakova VO, Linkova NS, Dudkov AV, Kvetnoy IM. Peptides regulate cortical thymocytes differentiation, proliferation, and apoptosis. J Amino Acids. 2011;2011:1-5.
- Khavinson VKh, Pronyaeva VE, Linkova, NS, Trofimova SV. Peptidergic regulation of differentiation of embryonic retinal cells. Bull Exp Biol Med: Cell Technol Biol Med.2013;1:172–5.
- Khavinson VKh, Razumovskii MI, Trofimova SV, Grigor'yan RA, Chaban TV, Oleinik TL, Razumovskaya AM. Effect of epithalon on age-specific changes in the retina in rats with hereditary pigmentary dystrophy. Bull Exp Biol Med. 2002;133(1):87-9.
- Khavinson V, Razumovsky M, Trofimova S, Grigorian R, Razumovskaya A. Pineal-regulating tetrapeptide epitalon improves eye retina condition in retinitis pigmentosa. Neuro Endocrinol Lett. 2002;23(4):365-8.
- Khavinson VKh, Sevostyanova NN, Durnova AO, Lin'kova NS, Tarnovskaya SI, Dudkov AV, Kvetnaia TV. Tetrapeptide stimulates functional activity of pancreatic cells in aging. Adv Gerontol. 2013;3(3):220–4.
- Khavinson VKh, Shataeva LK, Chernova AA. Effect of regulatory peptides on gene transcription. Bull Exp Biol Med. 2003;136(3):288–90.
- Khavinson VKh, Solov’ev AYu, Tarnovskaya SI, Lin’kova NS. Mechanism of biological activity of short peptides: Cell penetration and epigenetic regulation of gene expression. Biol Bull Rev. 2013;3(6):451–5.
- Khavinson VKh, Solov'ev AIu, Zhilinskiĭ DV, Shataeva LK, Vaniushin BF. Epigenetic aspects of peptide regulation of aging. Adv Gerontol. 2012;25(1):11-22.
- Khavinson VKh, Tendler SM, Vanyushin BF, Kasyanenko NA, Kvetnoy IM, Linkova NS, Ashapkin VV, Polyakova VO, Basharina VS, Bernadotte A. Peptide regulation of gene expression and protein synthesis in bronchial epithelium. Lung. 2014;192:781-91.
- Khavinson VKh, Zemchikhina VN, Trofimova SV, Malinin VV. Effects of peptides on proliferative activity of retinal and pigmented epithelial cells. Bull Exp Biol Med. 2003;135(6):597-9.
- Korneva EA, Rybakina EG, Kokryakov VN, Orlov DS, Shamova OV, Shanin SN. Interleukin 1 and defensins in thermoregulation, stress and immunity. Ann NY Acad Sci. 1997;81:465-74.
- Kozina LS. Effects of bioactive tetrapeptides on free-radical processes. Bull Exp Biol Med. 2007;143(6):744-6.
- Kuznik BI, Lin’kova NS, Khavinson VKh. Heat shock proteins: changes related to aging, development of thrombotic complications, and peptide regulation of the genome. Adv Gerontol. 2012;2(3):175-86.
- Kuznik BI, Lin'kova NS, Tarnovskaia SI, Khavinson VKh. Cytokinis and regulatory peptides: age-related changes, atherosclerosis and trombotic diseases. Adv Gerontol. 2013;26(1):38-51.
- Kuznik BI, Pateyuk AV, Rusaeva NS. Effect of tetrapeptides Lys-Glu-Asp-Gly and Ala-Glu-Asp-Gly on the structure and function of the thyroid gland in neonatally hypophysectomized chickens. Bull Exp Biol Med. 2008;145(1):104-7.
- Kuznik BI, Pateyuk AV, Rusayeva NS, Baranchugova LM, Obydenko VI. Effect of Lys-Glu-Asp-Gly and Ala-Glu-Asp-Gly Peptides of hormonal activity and thyiroid morphology in hypophysectomized mature and old birds. Adv Gerontol. 2011;24(1):93-8.
- Kuznik BI, Pateyuk AV, Rusaeva NS, Baranchugova LM, Obydenko VI. Effects of peptides Lys-Glu-Asp-Gly and Ala-Glu-Asp-Gly on hormonal activity and structure of the thyroid gland in hypophysectomized young chickens and old hens. Bull Exp Biol Med. 2011;150(4): 495-9.
- Labunets IF. Antigen-induced changes in the endocrine function of the thymus in CBA mice during aging: role of peptide factors released by the pineal gland. Bull Exp Biol Med. 2005;139(6):724-6.
- Labunets IF, Butenko GM, Khavinson VKh. Effects of bioactive factors of the pineal gland on thymus function and cell composition of the bone marrow and spleen in mice of different age. Bull Exp Biol Med. 2004;137(5):510-2.
- Linkova NS, Khavinson VKh, Chalisova NI, Katanugina AS, Koncevaya EA. Peptidegic stimulation of differentiation of pineal immune cells. Bull Exp Biol Med. 2011;152(1):124-7.
- Lin'kova NS, Drobintseva AO, Orlova OA, Kuznetsova EP, Polyakova VO, Kvetnoy IM, Khavinson VKh. Peptide regulation of skin fibroblast functions during their aging in vitro. Bull Exp Biol Med. 2016;161(1):175-8.
- Lin'kova NS, Kuznik BI, Khavinson VKh. Peptide Ala-Glu-Asp-Gly and interferon gamma: their role in immune response during aging. Adv Gerontol. 2012;25(3):478-82.
- Lin’kova NS, Polyakova VO, Trofimov AV, Kvetnoy IM, Khavinson VKh. Peptidergic regulation of thymocyte differentiation, proliferation, and apoptosis during aging of the thymus. Bull Exp Biol Med. 2011;151(2):239–42.
- Micans P. The new Russian peptide revolution. Aging Matters. 2016. (Spec 25 yrs ann edit):6-9.
- Raikhlin NT, Bukaeva IA, Smirnova EA, Yarilin AA, Sharova NI, Mitneva MM, Khavinson VKh, Polyakova VO, Trofimov AV, Kvetnoy IM. Expression of argyrophilic proteins in the nucleolar organizer regions of human thymocytes and thymic epitheliocytes under conditions of coculturing with vilon and epithalon peptides. Bull Exp Biol Med. 2004;137(6):588-91.
- Sevostianova NN, Linkova NS, Polyakova VO, Chervyakova NA, Kostylev AV, Durnova AO, Kvetnoy IM, Abdulragimov RI, Khavinson VKh. Immunomodulating effects of Vilon and its analogue in the culture of human and animal thymus cells. Bull Exp Biol Med. 2013;154(4):562-5.
- Turchaninova LN, Kolosova LI, Malinin VV, Moiseeva AB, Nozdrachev AD, Khavinson VKh. Effect of tetrapeptide Cortagen on regeneration of sciatic nerve. Bull Exp Biol Med. 2000. 130(12):1172–4.
